タンパク質や,生きた細胞の仕組みを理解するためには,対象を観て触れて調べるということが必要不可欠である.そのため,さまざまな観察法やマニピュレーション法が開発されてきた.光ピンセット法は,レーザービームを集光することにより放射圧・電場の強度勾配を作り,誘電休粒子を捕捉・操作するレーザーマニピュレーション技術である31).生体試料に光ピンセット法を用いる場合は,近赤外のレーザーがよく用いられる.近赤外のレーザーを用いると,細胞や生体試料にダメージをほとんど与えずに非接触で,捕捉・マニピュレーションをすることが可能となる32)33).
ここでは,光ピンセット法を用いたタンパク質操作,ならびにナノメートルの動きを捉える手段について,アクトミオシン分子モータ系に応用した例を紹介する.
41・3・1 光ピンセットのセットアップ
生体分子を観察しながら,マニピュレーションをおこなう一つの方法として,光学顕微鏡に光ピンセット法を組み込む場合を紹介する(図41・7).光学顕微鏡でタンパク分子を観察しながら操作し,その動きを高精度で測定する方法である.光ピンセット用のレーザーとしてはNd:YAGレーザーがよく用いられる.Nd:YAGレーザーは波長が1.064 μmと近赤外領域にあり,生体分子を破損せず,また,可視光領域の蛍光色素の吸収帯からも大きくはずれているので,蛍光標識した生体試料を光学顕微鏡下で直接観察・操作するのに適しているためである.光ピンセットは,ガウス型の強度分布を持つ単一モード(TEM00)Nd:YAGレーザーのビームを,開口数の大きな対物レンズで集光することにより実現する.現在,0.5~4 W出力のYAGレーザーを用い,直径0.2~1 μmのポリスチレンビーズを介してタンパク質を捕捉している34)~37).光学顕微鏡下で,位置を固定した光ピンセットを構成するには,視野絞りの位置に集光するようにレーザービームを入射すればよい(対物レンズが無限遠系の場合は,対物レンズに平行光を入射すればよい)(図41・7).対物レンズは関口数が1.3程度の大きなのものを用い,レーザービームの直径は,対物レンズの開口数に対して0.5~1の割合になるようにビームエキスパンダなどで調節する.生物学で用いられる対物レンズは基本的に可視光の範囲で機能するように設計されており,近赤外領域の特性までは考慮されていないことが多い.そのため,光ピンセットの性能は用いる対物レンズに依存する.どの対物レンズが光ピンセットに適しているかは,実際に使ってみないとわからない.
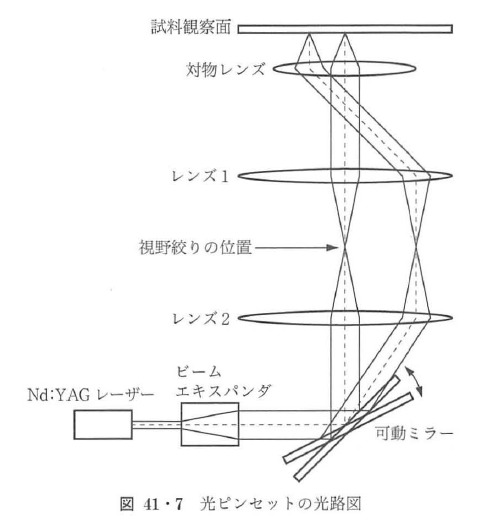
対物レンズの選定は,光ピンセットを用いている論文書などを参考にされたい.
光ピンセットを可動にし,観察画面上で操作したい場合は,レーザービームの光軌をミラーで調節することで笑現する.関口絞りと共役の位置に置かれたミラーでレーザービームを反射させ,そのミラーの角度をコントロールすることにより,観察画面上で光ピンセットを1方向(xyの2方向に操作したい場合はミラーを2枚入れる)に移動できる.
実際の分子観察においては,タンパク質分子一つ一つは,光学顕微鏡の分解能(~200 nm)以下の大きさ(~10 nm)であり,直接観察できないため,タンパク質を蛍光色素で標識し,高感度カメラを組み込んだ蛍光顕微鏡で観察する.こうした蛍光観察法と光ピンセット法を光学顕微鏡に実際に組むうえでは,対物レンズ後の,蛍光観察用のダイクロイックミラーと光ピンセット用のダイクロイックミラーの位置をどう配置するか,また両ダイクロイックミラーの分光特性などを考慮する必要がある.
41・3・2 タンパク質の操作とナノ測定
アクトミオシン分子モータ系では,アクチンフィラメントに沿って分子モータであるミオシンが運動する.ミオシンの大きさやアクチンフィラメントの直径は10 mm程度であるため,光ピンセットで直接捕捉・操作することはむずかしい.そこで,直径0.2~1 μmのポリスチレンビーズを介して捕捉・操作することにより,分子操作をおこなう34)~37).まず,ポリスチレンラテックスビーズを捕捉し,それにアクチンフィラメントをつけて操作する.ビーズの表面にはあらかじめ接着分子を結合させている.
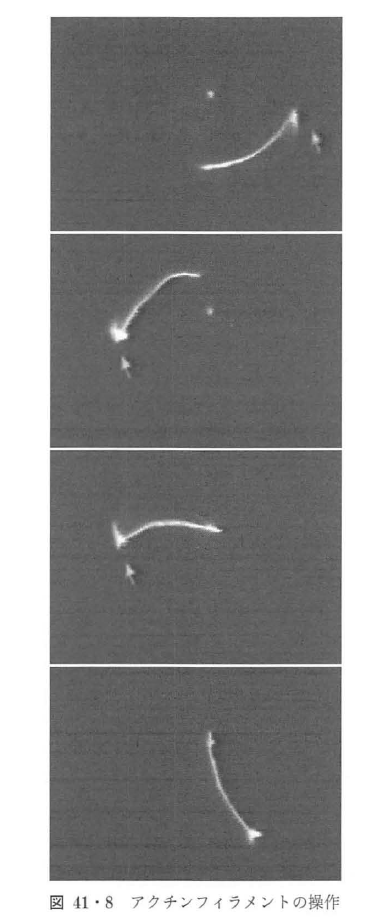
実際に,蛍光ビーズを光ピンセットでとらえ,蛍光標識したアクチンフィラメントをつかまえ,操作しているようすが図41・8である.この図では二つの光ピンセットが存在している.一つは固定の光ピンセットで, もう一つは,ミラーで光軸を変えることにより観察図面上xy面で操作が可能となっている.
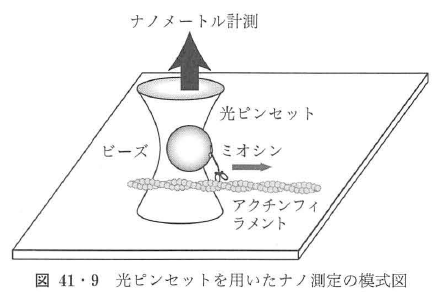
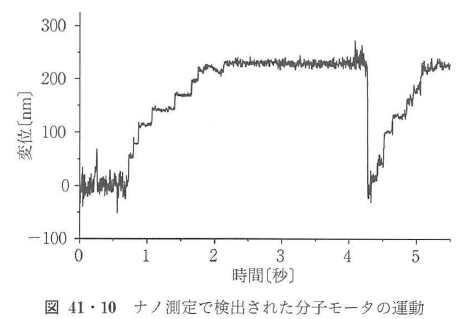
また,ビーズを使うことにより,タンパク質の運動をナノメートル・ミリ秒の精度ーで測定することが可能となる35)~37).光ピンセットで捕捉されているビーズを強い光(ハロゲンランプやレーザー光)で照らし,その明視野や暗視野像を4分割フォトダイオードに投影し,ビーズの像のずれを差分検出し,イ立誼を測定する.十分な量の光で照射してやればナノメートル・ミリ秒の精度での測定が実現する.ビーズをプロープとしてタンパク質を操作し,プローブとして位置を検出する.光ピンセットに捕捉されたビーズは,光ピンセットからばね様の捕捉力を受ける.レーザーのパワーと捕捉カは比例していて,1 μmのビーズを用いた場合,500 mW出力のレーザーを用いて,0.4 pN/mm程度の捕捉カが実現される.ばね様の捕捉カの範囲が-200~+200 nm程度であるので,50 pN程度の捕捉力となる.ミオシン1分子の発生する最大の力が数pNであることを考慮すると,十分である.捕捉力の大きさは実験の要求に依存するが,この実験では低負荷時の運動の大きさを測定するため実際にこれほど大きな捕捉カは必要ではなく,レーザーパワーを落として,0.01 pN/nm付近の捕捉力を使用している.実験では,レールとなるアクチンフィラメントをガラス表面上に固定し,ミオシンを吸着させたビーズを光ピンセットで捕捉・操作し,アクチンフィラメントと相互作用させる(図41・9)36)37).ビーズの位置をセンサーでモニターすると,アクトミオシン分子モータの相互作用によるナノメートルサイズの運動が観察される(図41・10).
ここで紹介したように,光ピンセットを用いた分子操作・ナノ計測は,ナノメートルサイズのタンパク質がどのように機能・運動しているか,を調べるのに非常に有力な手法である.DNA1本の操作や38),タンパク質分子どうしの結合力の強さの測定など39),さまざまに応用されている.AODやAOM(音響光学素子)などを用いることにより高速で強度や位置のモジュレーションをかけることも可能であるため,今後さまざまな研究への応用が期待される.
References and Links




