分子が光を吸収し,分子の電子エネルギーレベルが基底状態から励起状態に励起され,再び基底状態に戻る際,蛍光を発する.本節では,レーザー光など光を生体組織に照射した際,発生する蛍光により組織性状を診断する蛍光診断について,特に,内視鏡と組み合わせることで,従来の内視鏡では見つけることの難しい前がん組織や微小がんを検出する応用例を含めて説明する.
38・6・1 蛍光診断の原理
生体組織は,タンパク質など多くの分子が複雑に結合した細胞が多数集まり規則的に形づくられたものであり,その細胞を形成する分子には蛍光を発生する内因性蛍光物質が数多くある.
特に,表38・3に示すコラーゲン,エラスチン,NADH(ニコチンアミド・アデニン・ジヌクレオチド酸),FAD(フラビン・アデニン・ジヌクレオチド酸),ポルフィリン等の内因性蛍光物質は蛍光診断において極めて重要である.コラーゲン,エラスチンは粘膜下層に多く含まれる結合組織に,NADH,FADは細胞のエネルギー代謝に関わるミトコンドリアに,ポルフィリンは進行がんに多く含まれる.さらに,蛍光物質によって,励起波長,蛍光波長が異なることから,使用する光の励起波長・検出波長の違いによって,光の組織の進達度,励起される蛍光物質が変化してくる.
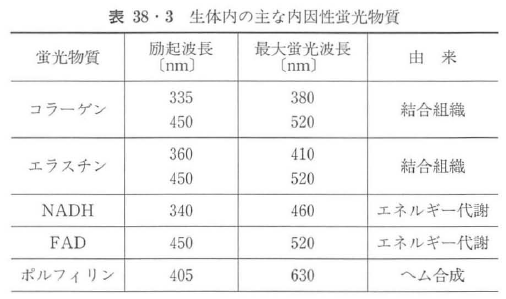
図38・24に360 nm(紫外光),390 nm(紫色光),440 nm(青色光)の励起光を大腸の正常組織とがん組織に照射したときの自家蛍光スペクトルを示す(がん組織からの蛍光強度は,各励起波長の正常組織の蛍光スペクトルのピーク波長で規格化した).
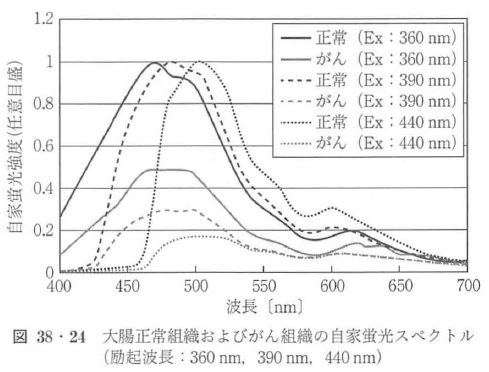
360 nmの紫外光で励起した場合,470 nmに極大を持つ自家蛍光スペクトルが発生し,これは主に粘膜層にあるNADHが蛍光を発生したと考えられる.また,440 nmの青色光で励起した場合には,510 nmに極大を持つ自家蛍光スペクトルであることから主に粘膜下層にあるコラーゲン及びエラスチンが蛍光を発生したものと考えられる(390 nmの紫色光で励起した場合は,その両方を含む).
正常組織に対し,がん組織の自家蛍光スペクトルの変化は,いずれの励起波長においても自家蛍光強度は減弱しており,これは主に粘膜下層にあるコラーゲンおよびエラスチンからの蛍光が吸収されたためと考えられる.また,いずれの自家蛍光スペクトルにおいても580 nm付近に血液(ヘモグロビン)の吸収による局所的な減弱があり,自家蛍光スペクトルが血液によって影響を受けていることがわかる.さらに,自家蛍光スペクトルは組織構造,がんの浸透状態,血液量により変化することから,胃,食道,気管支,など部位が異なったり,腫瘍のタイプや炎症の有無によっても変化してくる.
一方,蛍光診断においては,上記の内因性の蛍光物質を用いるほかに,生体組織には元来含まれていないが,正常組織と病変組織でその集積・排出特性が異なるヘマトポルフィリン誘導体(腫瘍親和性蛍光物質)を使う方法がある.この方法は,あらかじめ生体内に腫瘍親和性蛍光物質を注入し,病変部にその蛍光物質が特異的に残留するのを待って測定する.たとえば,ポルフィリン生合成の前駆体(precursor)からなる腫瘍親和性蛍光物質を生体組織に加えると,正常組織ではヘムを生成した後排出されるが,腫瘍組織ではヘム合成が進行しないため,プロトポルフィリンが長時間にわたって腫瘍細胞に蓄積される.この蓄積されたプロトポルフィリン誘導体の蛍光を測定することで,がんの診断をおこなうことができる.
腫瘍親和性蛍光物質としてはヘマトポルフィリン誘導体の2量体(dimer)であるdi-hematoporphyrin ether/esterの純度の高いDHE(photofrin II)が実用化されている.しかしながら,DHEは治療目的のために開発された蛍光物質で,高い投与量では肝障害を起こす可能性のあること,残留期間が長いため皮膚光線過敏症を起こしやすいことから,診断目的にのみ使用されることは少ない.最近では,ALA(5-アミノレブリン酸)やNPe6(mono-L-aspartyl chlorin e 6)など新しい腫瘍親和性蛍光物質が開発されている.
38・6・2 オプティカルバイオプシー
無料ユーザー登録
登録することで3000以上ある記事全てを無料でご覧頂けます。
- @optipedia.info ドメインより登録の手続きを行うためのメールをお送りします。受信拒否設定をされている場合は、あらかじめ解除をお願いします。
- Gmailをお使いの方でメールが届かない場合は、Google Drive、Gmail、Googleフォトで保存容量が上限に達しているとメールの受信ができなくなります。空き容量をご確認ください。
