1977年,F.F.Jobsisは近赤外領域(波長700~1300 nm)の光が生体組織に対し比較的高い透過性を示すとともに,生体組織の酸素代謝が非侵襲的に計測可能であることを証明した12).これは血液中のヘモグロビンなどに代表される内在的な分光学的酸素指示物質が生体組織内の酸素濃度に依存して吸収スペクトルを変化させることに起因している.その後の半導体レーザー技術や光検出技術などの発達とともに,この原理を応用した酸素代謝モニターが脳組織に対する虚血,低酸素状態または運動時の筋肉組織の酸素代謝の連続モニタリング装置として実用化された13)14).1993年には脳内部の神経活動に起因する局所的な脳酸素代謝変化の計測がいくつか報告され15)~17),その後,脳機能モニターやマルチチャンネル化による脳機能イメージング技術18)19)にも幅広く応用されるようになっている.
本節では近赤外光酸素モニターの原理と脳機能計測への応用を紹介する.また,生体組織は強い光散乱媒質であるので近赤外光酸素モニターには光散乱媒質に対応した定量的な分光計測が求められ,いくつかの新しい分光法が提案されている.その一つである時間分解分光法(time-resolved spectroscopy)20)~22)を利用した定量的な酸素代謝計測を紹介する.
38・3・1 近赤外光を利用した酸素モニター
[1] 分光学的酸素指示物質
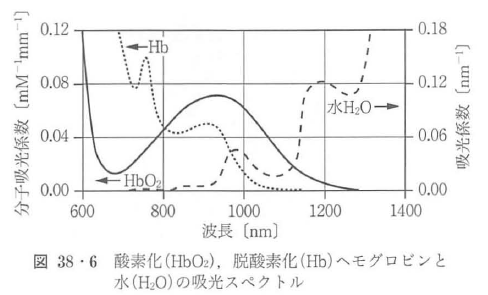
波長700 nmから1300 nmの近赤外領域では生体組織の光透過性が高く生体の分光学的窓(optical window)と呼ばれる.この領域では血液内に含まれるヘモグロビン(hemoglobin)分子と生体組織内に存在する水が主な吸光物質として知られる(図38・6参照).そのほかに筋肉中のミオグロビン(myoglobin)分子,細胞のミトコンドリア内に存在するチトクロームオキシダーゼ(cytochrome oxidaze),脂肪などが知られている(表38・1参照).これらの中でヘモグロビン,ミオグロビン,チトクロームオキシダーゼは酸素濃度に依存して吸収スペクトルが変化するため内在的な酸素濃度の指標23)となる.酸素モニター,脳機能計測にはヘモグロビン分子の酸素化,脱酸素化状態間のスペクトル変化が主に利用されている.チトクロームオキシダーゼは酸化,還元の状態変化が細胞内のエネルギー(ATP)代謝に直接関連しているため脳虚血,低酸素に対する指標として有効性が指摘されている23).

[2] 酸素モニターの基本原理
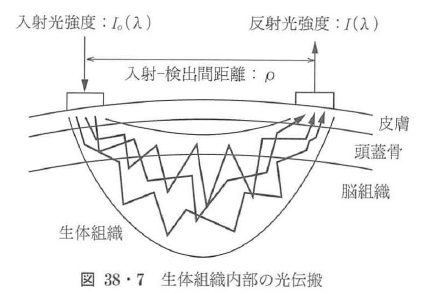
図38・7に示すように,生体組織内部に入射した近赤外光は光散乱を繰り返しながら拡散的に広がり,生体表面上の数cm程度離れた位置からでも容易に検出することができる.この拡散反射(透過)光に光散乱媒質の場合を考慮したBeer-Lambert則を適用する.
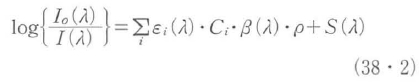
ここで,I0(λ),I(λ)は入射,透過(反射)光強度,λは波長,εi(λ)とCiはi番目の吸光物質の吸光係数と濃度,ρは生体組織(被測定試料)の物理的厚さ(入射-検出間距離),β(λ)は散乱による平均光路長(mean pathlength)β(λ)・ρの補正係数で,DPF(differential pathlength factor)とも呼ばれる.S(λ)は散乱による光の減衰項である.生体組織内部の酸素代謝の変動の結果,酸素化,脱酸素化へモクロビンの波度変化に起因する吸光度変化ΔOD(λ)は,
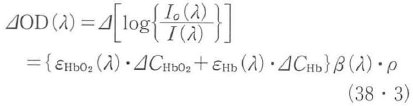
となるので,多波長計測を行い,β(λ)を一定と仮定することによってヘモグロビン濃度変化ΔCHbO2,ΔCHbと全へモグロビン(tHb)濃度変化(ΔCtHb=ΔCHbO2+ΔCHb)の相対的な値を決定することができる.これが近赤外酸素モニターの原理である.絶対(定量)的なヘモグロビン濃度変化量を決定するためには,式(38・3)のβ(λ)・ρである平均光路長の値を時間分解分光法(後述)などによって決定しなければならない21).
38・3・2 近赤外光を利用した脳機能計測
無料ユーザー登録
登録することで3000以上ある記事全てを無料でご覧頂けます。
- @optipedia.info ドメインより登録の手続きを行うためのメールをお送りします。受信拒否設定をされている場合は、あらかじめ解除をお願いします。
- Gmailをお使いの方でメールが届かない場合は、Google Drive、Gmail、Googleフォトで保存容量が上限に達しているとメールの受信ができなくなります。空き容量をご確認ください。
