がん手術において非腫瘍境界を強調するイメージング
腫瘍組織に優先的に蓄積する蛍光体への照射イメージングが、標準的な手法になる可能性がある。
患者は麻酔をかけられた状態で横たわり、2つの肋骨の間には小さな外科的開口部であるポータルが2つある。外科医はポータルから、ハサミ、把持鉗子、ステープラー、リモートカメラなどの胸腔鏡機器を操作する。コンピュータ断層撮影(CT)とポジトロン断層法(PET)の走査により、肺腫瘍が特定された。ここからが難しい。健常組織を可能な限り取り除かずに、腫瘍を完全に切除する。これは簡単なことではない。密集した領域は健常組織と明らかに異なるのだが、その境界はほとんど見分けできない。
そこで、外科医はスイッチを入れ、腫瘍領域を照射する(図1)。これに先立って標的となる蛍光体を注入しておくと、腫瘍組織と結合して、影響を受けない組織は見えなくなる。励起光は腫瘍を刺激し、より長い波長の光を発する。そのときに、外科医は光っている組織を取り除き、腫瘍を無事に切除できたことをほぼ確信できる。
標的となる蛍光ラベル、蛍光イメージングシステム、画像処理ソフトなど、必要なものはすべて入手できる。しかし、このような手術支援である蛍光ガイド手術(FGS、画像ガイド手術や術中イメージングとも呼ばれる)が使われることはほとんどない(図2)。
その理由は、他の新技術の開発と同様に、細部にある。標的となる蛍光剤は入手できるが、どの腫瘍に対してどの程度のコントラストが得られるのか。励起源やセンサは蛍光体を刺激して検出できるが、実用的な情報が得られるのか。これらの課題がクリアできたとして、FGSは患者の寿命延長や、より健康的な生活に貢献するのか。
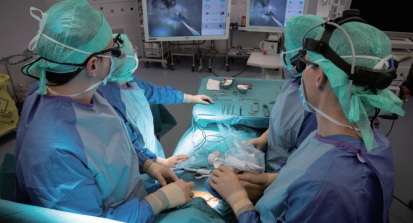
図 1 蛍光ガイド手術は、特定の組織を明確にできると期待されている。ここでは、750nmの照明とイメージングセンサを統合したハンドヘルド型のFluobeamを使用している。(提供:フリュオプティクス社)
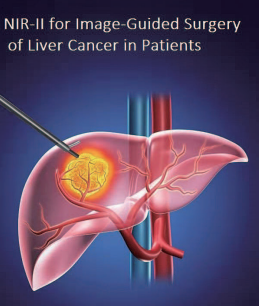
図2 蛍光ガイド手術の原理は簡単である。目的の組織を蛍光ラベリングし、その領域を照射して光った組織を取り除く。(提供:チェン氏)
付着して発光する
あらゆるFGS蛍光剤に求められるシンプルなことは、腫瘍と通常組織の間で高い可視コントラストをもたらすこと、つまり腫瘍に付着して光ることである。言い換えれば、腫瘍に集まり、通常組織には存在しないということだ。発光波長がバックグラウンド光と容易に区別しやすいこと、発光が正確に検出できるほど明るいということである。
現在、FGSで一般に使用されている蛍光剤は3種類のみである。インドシアニン・グリーン(ICG)、5-アミノレブリン酸塩酸塩(5-ALA)、フルオレセインナトリウムだ(表)(1)〜(3)。ICGとフルオレセインは血管イメージングラベルであり、成長する腫瘍に特徴的な、血流が過剰に多い場所に蓄積する。少なくとも脳では、ICGは投与後24時間、いわゆるセカンドウィンドウと呼ばれる時間帯まで蓄積し続ける。5-ALAは蛍光体ではないが、ヘム合成経路の中間化合物である。代謝が亢進している腫瘍では、別の中間化合物であるポリポルフィリン-IX(PpIX)を介してヘムを過剰生産するようになる。5-ALAが過剰に存在すると、これらの細胞はPpIXをさらに産生し、ピンクの蛍光を発する。
コントラストに影響を及ぼす因子は、細胞や腫瘍ごとに異なる可能性がある。しかし、そのような制限があったとしても、FGSは最も難しい腫瘍ターゲットのいくつかについて、その価値がすでに実証されている。
難題に挑む
がんはあらゆる組織を攻撃するが、最も壊滅的なものはおそらく、体で最重要財産である脳にできる100種類以上のがんだろう。腫瘍は肉眼でも見える部分があるが、境界はしばしば不明瞭である。脳腫瘍を切除するときは、他の部位とは異なり、外科医は腫瘍組織を見つけるために触診することができない。さらに、他の臓器と異なる点は、組織の余分な切除は高リスクであることだ。
悪性度の高いグリオーマは、脳腫瘍の中でも最も侵略性が高い。見えにくく、触れることもできず、切除しないと広がる。しかし、余分な「安全マージン」を切除してしまうと、神経学的障害による衰弱を引き起こす可能性がある。術前のCTまたはMRIによって腫瘍の中心領域を特定できるものの、手術で頭蓋を開けると1cm程度の「脳偏位」が生じるため、予備的な情報はほとんど役に立たなくなる。
もし、FGSの使用に最も適した状況があるなら、このときである。
2006年、ウィリアム・スタマー氏(William Stummer)らはドイツの17の外科施設で、FGSの初の大規模臨床試験を完了した(2)。5-ALA投与後のPpIX可視光蛍光を利用した外科医は、標準的な白色光照明を利用した外科医と比較して、2倍の効率で腫瘍を切除した。がん治療の標準的なベンチマークである、術後6ヶ月間の無増悪期間の割合も、FGSを実施すると2倍になった。
その後、5-ALA(2)、フルオレセイン(3)、ICG(3)を用いたさらなる研究により、脳腫瘍をはじめ、皮膚がん、大腸がん、膵臓がんなど、10種類以上のがんの手術効率を測る指標である全切除(GTR)も、同様の改善が見られた(3)。
北米で早くから5-ALAを腫瘍イメージングに使用してきたグループの1人で、米ニューハンプシャー州のレバノンにあるダートマス・ヒッチコック・ヘルス
(Dartmouth-Hitchcock Hea lth)外科イノベーションセンターの科学主任であるキース・ポールセン教授(Keith Paulsen)は、「著名な神経外科医数名が視察し、主任外科医は最初に見たとき、『火山のようだ』と言った」と述べる。
特異性を持たせる
承認されたイメージング剤の成功、一般に全切除が2倍というものは印象的だが、スタマー氏が最初に行った影響力のある大規模試験においても、腫瘍を完全に切除できる確率は3分の2に過ぎなかった。FGSの価値は十分に示したものの、より特異的な蛍光マーカーの必要性も十分に示された。
より特異的なマーカーを作るための解決策は、腫瘍のみに存在する化合物、あるいは現実的には、腫瘍に主に存在する化合物を見つけるところから始まる。そして、抗体や抗体様分子、ペプチド、低分子、ナノ粒子など、ターゲット化合物に強く結合する標的部位を探す(または作る)。それを、光る蛍光体に結合させる(3)〜(6)(図3)。もし、マーカーが近赤外(near-IRまたはNIR)で蛍光を発するのであれば、ボーナスポイントだ。NIRなら、組織の吸光と散乱が最小限に抑えられるからである。概念上はシンプルだが、実際には課題が山積みだ。
ポールセン氏とダートマスの同僚らは、手術の結果を改善する機器の開発に専念していたが、「使える蛍光体があまり登場しなかったことに不満を抱いていた」と、同氏は話す。蛍光体の開発を加速させる米国立がん研究所(National Cancer Institute、NCI)のプログラムの一環として、ダートマスのチームは、スウェーデンのアフィボディ社(Affibody)の結合タンパク質を米ライコア社(Li-Cor)の蛍光体に結合させ、新規イメージング剤ABY-029を作製した。
この58アミノ酸のペプチドは、腫瘍で過剰発現している血管内皮細胞増殖因子受容体(EGFR)に結合する。776nmで吸光して792nmで発光することで、ICGの3倍の明るさを持ち、目立った副作用のない新たなイメージング剤である。ABY-029は、ちょうどマイクロドーズ試験が終了したところだ。「ABY-029は腫瘍に優先的に蓄積し、非常に低い投与量でも蛍光を検出できることが示された」とポールセン教授は話す。「現在フェーズII試験に移行しており、診断薬としての有効性と、手術における精度の効果を検討している」。
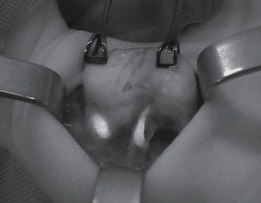
図3 副甲状腺は甲状腺の上で位置が異なるため、自家蛍光を励起光して可視化できるようFluobeamが開発された。(提供:フリュオプティクス社)
(もっと読む場合は出典元へ)
出典元
http://ex-press.jp/wp-content/uploads/2021/07/032-035_bioft_medical_imaging.pdf
