COVID-19との戦いを可能にする光学とフォトニクス
SARS-CoV-2の初期シーケンスから、空気濾過で使われる紫外線 LED、そしてリアルタイムPCRなどの分光法を用いた診断検査まで、光学とフォトニクスはCOVID-19との戦いを可能にしている。
近年の歴史の中で他のあらゆるイベントよりも、COVID-19はこの1年間、日常生活に大きな影響を与えた。パンデミックが世界を支配し続ける中、大衆はこれまで以上に検査、治療、消毒、ワクチン開発の最新情報を注視するようになっている。驚くべきことに、すべてのメディアが注視する中で、これらの進歩の多くはフォトニクスなしに不可能だったという事実はほとんど注目されていなかった。
「フォトニクスとは、可能にする技術である」という、コミュニティ内ではよく言われるこの言葉は、COVID19に関してはこれ以上ないほど適切だろう。なぜなら、生体医学がフォトニクスの影響を最も大きく受けた分野であることは、疑いようのないことだからである。実際、遠隔通信を除いて、ヘルスケアほどフォトニクスの影響を大きく受けている産業はないと言っても過言ではない。そこで、COVID-19パンデミック対策にフォトニクス技術がどう応用されているか、深掘りすることにしよう。本稿では、COVID-19検査でフォトニクスは現在どう応用されているか探ると同時に、現在、フォトニクスが次世代技術をどう促しているか見ていこう。
COVID-19検査における蛍光の役割
COVID-19のアクティブな感染を診断するために最初に行う試験方法には、逆転写ポリメラーゼ連鎖反応(rtPCR)と呼ばれるプロセスが含まれている。PCRとは、DNAを指数関数的に増幅させる方法である。そのため、rt-PCRのプロセスをよく理解するには、まずDNA分子の基本的な構造を振り返ることが重要である。DNAは2本鎖の分子であり、アデニン(A)、シトシン(C)、グアニン(G)、チミン(T)の4種類の核酸から構成される。アデニンとチミンのみ、グアニンとシトシンのみの結合様式をとり、塩基対を形成する。塩基対は、4ビットのゲノムコードを作り、DNAの自己複製を容易にする。
通常のPCRでは、DNA鎖を変性させて「ほどく」ことにより、2つに分ける。次に、ポリメラーゼと、対象となるゲノムに合わせて設計したDNAコードのプライマーを加える。ポリメラーゼは化学的プロセスを開始し、2つに分かれたDNAはそれぞれ適切な核酸で「埋まり」、2つの完全なDNA分子が作られる。このプロセスを繰り返し、4分子、8、16……と、DNA総量は指数関数的に増加する。この増幅が起きるのは、DNAの塩基配列がプライマーの塩基配列と一致する場所のみである。そのため、COVID-19の原因ウイルスであるSARS-CoV-2のように、特定の抗原の存在を確認するために選択性の高い測定技術となっている。コロナウイルスは1本鎖のRNAウイルスであるため、最初にRNAをDNAに変換する追加手順が必要となることに注意すべきだ。それゆえ逆転写が必要だが、結果は同じである。
標的DNAをタグ付けするために使うのは、片方の端に蛍光分子を、もう片方の端に消光分子を持つ低分子RNAである。消光分子が近くにあると蛍光分子は不活化され、溶液中では活性がない。しかし、標的RNAと結合した後は、ポリメラーゼによって蛍光分子が放出され、活性化する(図1)。PCRプロセスが繰り返させると、蛍光シグナルは最終的に検出できるほど強くなる(1)。従って、すべてのPCR検査システムには励起源(通常はLED)、光検出器、複数の光学フィルタを必要とする。
抗体検出もまた、過去に感染したかどうかを判断したり、ワクチン接種の効果を確認したりするための強力なツールである。現在、抗体検査のゴールドスタンダードは酵素結合免疫吸着測定(ELIZA)だ。ELIZA法は、抗体によって固定化される抗原から構成される。この抗原は、マイクロプレートアレイのウェル内に配置された基板と結合している。サンプルに触れると、血清中に抗体がある場合、抗原に結合する。レポーター分子をつなげた2次抗体をウェルに加え、比色法または蛍光で検出する。そのため、ELIZA検査システムにはrt-PCR検査システムと同様の光学コンポーネントを必要とする。
こうしたことから、COVID-19に対するrt-RCT検査とELIZA抗体検査はすべて、単にフォトニクスに依存しているのではなく、根本的には光学分析である。
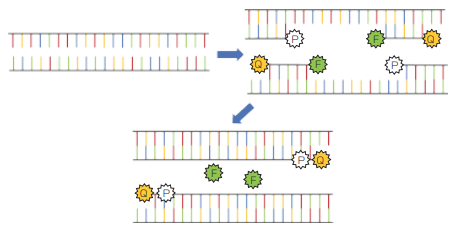
図1 PCR中の蛍光活性の模式図。Pはポリメラーゼ、Fは蛍光分子、Qは消光分子を示す。
臨床現場における迅速スクリーニングの開発
ELIZAやPCR検査の価値が低く見られているわけではないものの、残念ながらどちらも臨床現場(POC)における迅速な検査には適していない。例えば、ELIZAは一般的に96ウェルプレートで行い、多数のサンプルを同時に検査できるにもかかわらず、サンプルのインキュベーション時間のために総測定時間は数時間もかかることがある。幸運なことに、Laser Focus World誌2020年8月号で詳しく紹介されたように(2)、現在のパンデミック以前から、最新の分光技術がPOC医療診断の道
を切り開いてきた。最も有望なPOCスクリーニング法は、表面プラズモン共鳴(SPR)センサと、表面増強ラマン散乱(SERS)免疫測定の2つである。
SPRセンサによるPOC抗体検出
表面プラズモンとは、金属と誘導体の界面における伝導帯電子のコヒーレント振動によって発生する表面波である。その結果、表面プラズモンは、物質の誘導率(屈折率の平方根)の変化に非常に敏感である。それゆえSPRセンサは、屈折率測定、干渉法、分光法によって誘導率の変化を迅速に測定できる。
(もっと読む場合は出典元へ)
出典元
http://ex-press.jp/wp-content/uploads/2021/07/024-027_bioft_biomedicine.pdf
