生命が持つ速度で見る高解像度なマルチカラー 3Dイメージング
革新的なレーザ蛍光技術である掃引共焦点平面励起(SCAPE)顕微鏡法は、以前の手法の限界を克服し、幅広いライフサイエンス分野での有用性を提供している。
生命科学の多様な分野の研究者たちが共通して求めているものに、3D蛍光顕微鏡ツールがある。3D蛍光顕微鏡ツールは、高速で高画素数、一細胞分解能が特徴で、対象物に光損傷をほとんど与えずに画像を取得できる。多くの開発と技術的な改善にもかかわらず、確立された技術のほとんどは、前述したパラメータの少なくとも1つを妥協するトレードオフがいまだに存在している。
進歩とトレードオフ
例えば、共焦点顕微鏡法は、マルチヘルツの繰返周波数にて巨大なxyz体積を高解像度で画像化できない。これは、単一スポットを走査する速度に物理的な限界があるからだ。さらに、1ピクセルあたりの滞留時間が短いため、最速の共焦点走査には高出力のレーザを必要とするが、結果として生きたサンプルに大きな光損傷を与えてしまう。
二光子顕微鏡法は光損傷を劇的に抑えるが、このような一点アプローチには速度・解像度・体積のトレードオフがあり、結果として同じ問題に直面する。最近開発された高速な音響光学変調器(AOM)は、事前に選択した小さな体積を高速に走査できるが、この方法は巨大な体積または動く生物に限定される。
従来のライトシート顕微鏡法では、xy面全体を同時にサンプリングできるが、試料に側面からアクセスする必要があり(それゆえ特別な準備も必要)、3Dデータを構築するにも時間がかかる。さらに、光学系の同期とステージの移動が必要で、これらの技術は複雑かつスローである。
米コロンビア大(Columbia Uni versity)のズッカーマン精神・脳・行動研究所(Zuckerman Mind Brain Behavior Insti tute)のエリザベス・ヒルマン教授
(Elizabeth Hillman)と彼女の同僚は、マウントの有無に限らず、さまざまなサンプルの形状をサポートしながら、上記の制限を超える革新的なアプローチの開発に取り組んだ。成功した結果は、2015年に初めて掲載された(1)。
アップデートされたバージョンであるSCAPE 2.0は2019年に報告され(2)、ライフサイエンスで幅広い有用性を認めた独ライカ・マイクロシステムズ社(Leica Microsystems)が現在使用権を取得している。
SCAPEの原理
ヒルマン教授は次のように説明する。「シングルまたはマルチビーム走査では真に高速なイメージングを実現できないと考えていた。仮に必要とする走査速度を得られたとしても、各ピクセルの滞留時間が短すぎるため、許容できるシグナルノイズ比で画像を取得できないだろう。そこで、ライトシート顕微鏡について考え始めた。当時のほぼすべてのシステムでは、試料の周辺でお互いに90度となるよう対物レンズを2つ設置する必要があった。そこで生じた疑問は、単一の対物レンズ構成の中に、ライトシートのマルチピクセルの利点を組み合わせることはできないか、ということだった」。
チームは、高開口数の対物レンズの端を通る軸外パスを使用することで、顕微鏡の真のxy平面に対して45度の位置で励起光シートを作成できることを発見した(図1)。この斜面からの蛍光を画像化するために、斜面顕微鏡に似た手法を使用し、対物レンズのイメージング面を回転させて正確にカメラの焦点を合わせる(3)。ヒルマン教授のチームは、ライトシートを左右に動かすために、対物レンズの上流に走査ミラーを使用する。走査ミラーは、移動するライトシートで焦点を維持するため、蛍光を反射させてリダイレクトする役目もある。ミラーの動きに合わせて平面を重ねることで、3Dボリュームの画像を素早く、繰り返し生成できる。
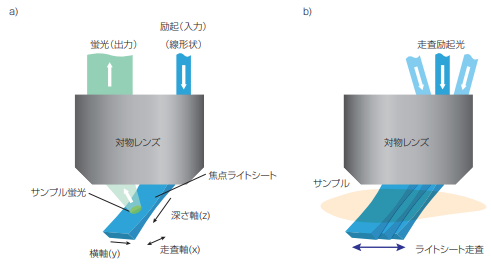
図1 SCAPEでは、線形状のビームを用いる顕微鏡の一次対物レンズの軸外照明によって、斜めにライトシートを形成する(a)。SCAPEは、照射された平面の連続イメージを取得しながらライトシートを走査することで、立体画像を構築する(b)。
(もっと読む場合は出典元へ)
出典元
http://ex-press.jp/wp-content/uploads/2021/04/016-019_bioft_fluorescence.pdf
