腫瘍構造を深く知ることで前進するがん診断と治療
新しいレーザアブレーションとマスサイトメトリーの融合により、個々の細胞の表現型を空間的に分解できるようになり、がん診断と治療の新たな進展が期待されている。
顕微鏡による細胞型の評価とゲノムまたはプロテオーム解析、すなわち、がん細胞の機能に関する詳細な情報をもたらす近年の技術革新により、がん診断と治療の向上が可能となっている。しかし、悪性細胞の遺伝的プロファイルが腫瘍成長の主要因である一方で、他にも多くの要因が同様に重要であることが、多くのエビデンスによって明らかになっている。その要因には、腫瘍構造や腫瘍細胞間の相互作用、間質、細胞外マトリクス、免疫細胞などがある。
最近まで、これら複雑な相互作用を空間的な方法で包括的に調べることができず、がん診断や予後、治療において腫瘍構造が果たす役割を完全に解明するには限界があった。個々の細胞の表現型を空間的に分解するパワフルなツールであるイメージングマスサイトメトリー(Imaging Mass Cytometry:IMC)は、がん診断と治療を前進させる次の革命をもたらす可能性を秘めている(1)。
IMCは、米フリューダイム社(Fluidigm)が商標登録しているもので、マスサイトメータとして使用するために新しいレーザアブレーション装置を採用している(図 1)(2)。組織または固定した細胞サンプルを金属タグ付きの抗体パネルで染色し、213nmで動作するパルスレーザを用いてアブレーションチャンバ内で走査し、直径1μmのスポットサイズに焦点を当てる。
そして、マスサイトメトリーは各スポットから気化した組織を分析する。気化した各サンプルに存在する金属タグを計測し、サンプル内の各スポットの位置に対してインデックスを作成する。スポットを単位として基盤の中でサンプルを連続的に移動させることで、組織上のタンパク質の分布を描いたサンプルのマップを作成する。マップは、空間的な情報も持つ単一細胞のタンパク質分析に使用できる(3)。
IMCの実力は、同時に解析できるタグの数に応じて大きくなる。現在、安定した金属同位体ラベル、またはタグは37種類あり、最大37ターゲットを同時に測定できる。これらのタグから得られるデータは、機能的バイオマーカー分析や、IMCイメージをさらに適応させてセグメント化するDNAインターカレータのような他の「ナビゲーション補助」と統合できる。こうして、デジタル病理学や多重シングルセル解析と融合して、新たな診断、予後、治療クラスを特定できるかもしれない(3)。
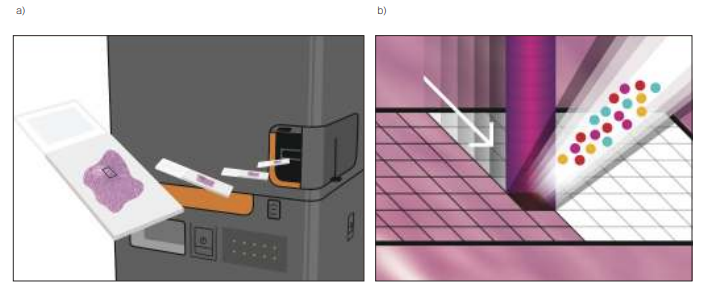
図1 イメージングマスサイトメトリー(IMC)は、ユーザーが抗体染色した標本を用意してスライドをHyperion Imaging Systemに挿入し、システムコントロールを用いて画像化する対象領域を選択するところから始まる(a)。システムのパルスレーザは213nmで動作し、正確なイメージングを可能にする。ビームは直径1μmで集光され、金属タグ付きの抗体で染色したタンパク質をサンプリングし、これらのタグを管理して誘導結合飛行時間(ToF)技術で解析する。選択された領域でレーザが1平方マイクロメートルの各ピクセルをサンプリングするため、1回の走査で済む(b)。
先進的な性能に向けた空間的解析
標的療法は、特定のがん種では大きな恩恵をもたらしている。しかし、これらの恩恵が限られる場合もある。腫瘍や周囲の微小環境内の細胞非均一性が高いため、治療ターゲットの細胞がなかったり、治療が目的の細胞に到達できなかったりする。こうしたことから、腫瘍に存在する少数の細胞の組織学的特徴や分子プロファイルに基づくのではなく、腫瘍の構造解析に基づいた固形腫瘍の診断、分類、治療に対する新たなアプローチをIMCが可能にすると見込まれている。最近発表された2つの論文では、細胞の表現型におい
てゲノム変化が果たす役割の理解を深め、乳がんにおける患者特異的な診断をさらにもたらすために、IMCがどう利用されるかについて述べている。
(もっと読む場合は出典元へ)
出典元
http://ex-press.jp/wp-content/uploads/2020/09/040-042_bioft_laser_ablation.pdf
