スーパーディープデプレッションCCDがバイオラマン分光を最適化
新しいCCDは、バイオラマン計測に適した波長で 2 ~ 7倍高感度になり、検出限界を拡大し実験時間を短縮する。
過去100年で、ラマン分光法は、材料や分子の構造研究の重要ツールであることが証明された。過去20年にわたり、ラマン分光法は、生物学、医療及びライフサイエンスの分野で働く人々から大いに注目されるようになった。さまざまなクラスの生体材料や分子を検出し、病気を特定し、診断ツールとして役立つ可能性があるためだ。これらの分野の他の技術と比較してラマン方法は、高い分子特異性を実現し、ラベルフリーで非破壊であり、またサンプルの準備もほとんど必要ないか、または全く必要ない。
ラマン分光法は、一般にはレーザビーム、励起光源の波長シフトを計測する。これは、非弾力性散乱光を検出することによるものである。その光は、調べているサンプルの分子で振動を起こすために利用されているエネルギーの結果としてシフトした散乱光である.アプリケーションでのラマン分光法の有用性は、2つの事実に依存する。(a)多様な分子のラマンスペクトルが、物質を特定するために使用できる固有のフィンガープリントを作る。(b)ラマンラインの強さと位置が、サンプルの化学物質(例えばpH値)または物理的(例えば、歪、温度)特性のいずれかによって敏感に影響される。
アプリケーション
ラマン分光法のアプリケーションについて、広範囲の研究が行われている。現在、学界や産業界の研究者が、その技術をさらに広く利用できるようにするための測定器を開発している。ラマン分光法は、バイオセンシング、医療診断と処置に関わる幅広いアプリケーションに適用可能である。感染の検出、細胞の分類、細胞環境や代謝のモニタリング、また薬剤送達のモニタリングに利用できる(1)。
多くのアプリケーションは、内科病理学、体外と体内の両方で特にガン組織の特定、手術の成功をモニターし評価する有望なツールとしてのその技術の利用に関与している。ラマン分光法は、肺、乳房、消化器官、前立腺、皮膚及び脳の組織の健全性と腫瘍の識別することが示された。
その技術の有用性の一例は、さまざまなタイプの組織の特定である(図1)。異なるタイプの組織は、さまざまな強度と多様な波長でラマン散乱光を発する。個別のスペクトル線を組織の細胞内の特定の分子構造、脂質やアミノ酸など、C-H結合など特定の分子群まで追跡できる。これらのラマンスペクトルは、広範囲に分析され、一覧にされている。
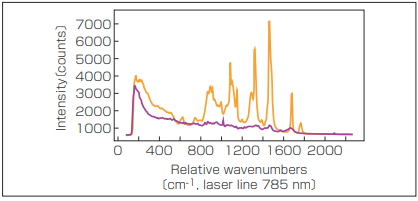
図1 脂質の多い脂肪組織(オレンジ)とタンパク質を多く含む筋組織(紫)のラマンスペクトル 。ブロードバンド自家蛍光バックグラウンドが両方のスペクトルにはっきりと見える、それぞれ同じ取得時間で収集されたものである 。
SERSによる増強
ラマン効果は、プラズモン、金属ナノ構造付近の電場増強により数ケタ増強可能である。表面増強ラマン散乱(SERS)は、ラマン技術の感度を大いに強め、ラマン法が利用されている多くの生物学的、医療アプリケーションで有用性が証明されている(図2)。
前述のナノ構造は、溶液ベースのナノ粒子または、マイクロ流体デバイスと結合できる人工ナノ構造面のいずれかである。さらに、SERS粒子は、機能的にすることができる。これは、極めて特殊な生化学物質や分子をモニターする技術の標的を改善することが目的である(2)。
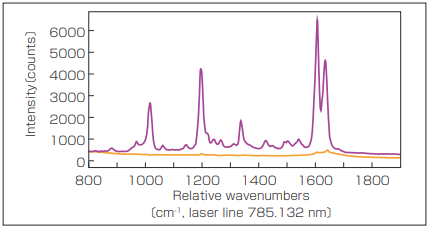
図2 ゴールドナノ粒子を使用する SERSスペクトル 。標準スペクトル(オレンジ)と比較した SERSスペクトル(紫)の信号増強ははっきり見える 。両方のスペクトルとも同じ実験設定で取得された 。
ラマン計測器
ラマン分光計測の主要設定は、すべてのアプリケーションで同じである。レーザ光源を使いラマン放出を励起する。光学系が励起光をサンプルに転送し、ラマン発光を収集する。これをスペクトログラフに搭載したカメラで検出する。
セットアップでは、光フィルタを利用してレーザラインを不要な人工物から区別し、弾性散乱光を吸収する。これは、弱いラマン放出だけを分光器でとらえるためである。ラマン放出のエネルギーは励起レーザに対してシフトするので、励起波長はラマン実験では極めて重要なパラメータである。それが信号の波長範囲を決めるからである。
組織及び体内観察のラマン分光法では、強力な自家蛍光がサンプルから放出され、ラマン信号に重なる。この現象が、観察時間を制限し、信号ノイズを増やす。自家蛍光信号は、励起波長を高くすることで大幅に低減されるので、近赤外(NIR)の比較的高い励起波長を利用するのが望ましい、通常は785nmまたは830nm発光のレーザを利用する。
一般に、光学系はアプリケーションに適合させている。細胞や組織の内部構造を研究する実験は、顕微分光法セットアップを利用する。これにより、高い空間分解能のために共焦点取得を必要とし、スキャニングシステムと組み合わせて、サンプルのハイパースペクトルモップを提供できる。
体内では、実験は柔軟性の高さが求められるので、ファイバオプティクプローブを使う。ファイバオプティクプローブは、ラマン分光法を臨床応用に移行させるための決定的な要素である。最近の文献で、さまざまなプローブの適切な概観が紹介されている。これらは、与えられたアプリケーションに強く依存するものである(3)。
(もっと読む場合は出典元へ)
出典元
http://ex-press.jp/wp-content/uploads/2020/07/36-38_spectrometers.pdf
