深部組織で細胞以下のサイズの定量位相イメージングを付加する
蛍光顕微鏡法の限界を克服するのが位相イメージングだ。このリアルタイム技術の最新の発展は、厚みがあり強く散乱する組織において、ラベルフリーかつ定量的な 3Dトモグラフィを拡張し、ナノメートル解像度と驚くべきコントラストをもたらしている。
生きた細胞や組織への光学顕微鏡法は、生命科学の研究者にとって知見の主な情報源である。その一方で、薬剤や疾患の影響を測定することが強く求められている。なぜなら、観察に数時間から数日を要するからだ。事実、薬剤研究には、生きたサンプルで定量的かつナノスケールな3Dトモグラフィの機能的測定を可能にするハイスループットで非侵襲的、ラベルフリーな技術が必要である。理想としては、細胞ベースのアッセイの光学イメージングは、巨大集団の細胞間で不均質な特性を素早く評価するのに十分なほどの感度を有するべきである。そして、サンプルの3Dイメージングは、理想的には、多重散乱のバックグラウンドを抑制し、焦点外の光を抑制する強固な切片法を作ることであろう。だが薬剤スクリーニングの方法論は、1990年にinvitro(生体外)のヒト細胞株のスクリーニングが導入されてから本質的には変わらずにいる。既存の方法は細胞生存の全体的効果の情報をもたらす一方で、巨大なサンプルサイズのバルク計測に制限される。そのため、個々の細胞レベルにおける増殖動態は測定できない。
定量位相イメージング(QPI)は、これらの領域すべてに到達する顕微鏡法である。ラベルフリーで低照度という性能のため、QPI法は非破壊的であり、
そのため安定して長時間の観察に適している。加えて、広視野をイメージしながら同時に3Dでサブミクロン解像度を提供する。
確立されたQPI技術は、空間光干渉顕微鏡法(SLIM)として知られており、一細胞のように薄くて透明なサンプルを観察することに優れている(図 1)。現在、勾配光干渉顕微鏡(GLIM)とよばれる新しいQPI技術は、光学的に厚みがあり、強く散乱する組織において、ラベルフリーかつ定量的な3Dトモグラフィイメージングを拡張しており、ナノメートル解像度と驚くべきコントラストをもたらす。このいずれも、生命科学研究と創薬にとって、重要な意味をもつ。
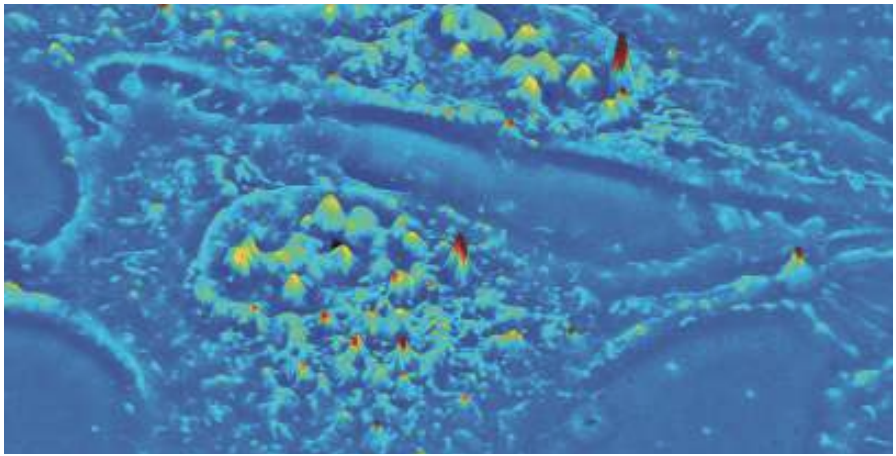
図1 SLIMの定量位相画像によるU-2 OS細胞の3D表面画像を示す。
創薬を加速する
多くの創薬パイプラインでは、初期の臨床試験で失敗する(1)。これが示唆するものは、より予測可能なバイオマーカーと前臨床の細胞毒性モデルが必要であるということだ。補助療法の個別化を開発するために細胞増殖を真に理解するときには、細胞ベースの増殖アッセイにおける薬剤効果、そして一細胞レベルの形態、表現型の変化に関する定量的な情報が求められる(2)~(4)。
前臨床研究(5)〜(7)は、3D組織モデルが臨床における腫瘍の複雑性や不均質性(8)を再現するのに役立つことを示唆する。これには細胞間相互作用、低酸素、薬剤の透過性・応答性・抵抗性、細胞外マトリックスの産生と沈着が含まれる。オルガノイドとよばれる組織様の構造(9)~(11)が、in vivo(生体内)におけるがん細胞の表現型、機能、シグナル経路の制御を簡略化するのに使われている(12)。そのように光学的に厚みがあるin vitro の3D構造には、生きたまま長時間の可視化と定量化、それも細胞以下のサイズで多細胞スケールなハイスループットが要求される。
現在の手法
生きた細胞は、含水量が多く天然の色素がないため、顕微鏡下での観察が困難なことで有名である。現在の手法は、造影剤(ナノ粒子を含む蛍光分子または色素)を直接または遺伝的な改変によって補う(13)~(15)。特殊な光源をもつ光学顕微鏡は蛍光分子を励起させ、定量的なパラメータを測定できるよう生きた構造や現象を強調させる。イメージングは短時間のインターバルに制限しなければならない。なぜなら、内部の光エネルギーは光褪色(15)、(16)と光毒性( 17)~( 21)をもたらす。
位相コントラスト(PC)顕微鏡法(22)や微分干渉コントラスト顕微鏡法(DIC)(23)のような古典的な技術は、外因性の化学物質を用いずに生きた細胞を描画できる。光がサンプルを通過するときに生じるわずかな差からコントラストを作るためだ。しかしながら、PCとDICは定性的な測定しかできない。強度差は、サンプルにおける光学密度差と一意に関連しないからである。
どのような光学手法を用いても、厚みのある3D生体構造をイメージングする際には、多重散乱のためにコントラストが失われる(24)。厚みが増すにつれ、多重散乱によってバックグラウンドの非干渉性が生じ、シグナルノイズ比(SNR)が指数関数的に減少する。生きた3D生体構造をイメージングする現在の手法(25)は、対象に結合した蛍光タグからのシグナルの空間的分布の検出に基づいている。
共焦点顕微鏡法(CM)(26)は、焦点外のバックグラウンド蛍光を排斥するためのピンホールを用いる。これにより、従来の広視野蛍光顕微鏡法よりも厚いサンプルの光学的切片を可能にする。しかし、イメージングの深度が増すほど、照度ビームの焦点がずれ、ピンホールを通過する光は弱くなる。このため、CMの透過限界となるサンプルの厚さは100μmである(27)。
レーザ走査型共焦点顕微鏡法(LSCM)は、回転盤共焦点よりも精細な軸光学切片をもたらす。サンプルへのスポット照明と、ピンホールで反射ビームの空間的フィルタリングを実行することで、外因性の光を排斥する。LSCMは大量の光を排斥するために非常に小さい絞り値を用いるため、高強度の光源、明るい蛍光タグ、サンプル固定が必要だ。
二光子顕微鏡法や三光子顕微鏡法(28)、(29)は、光褪色を減らして深部(200 ~300μm以下)を描画する。一方で光シート顕微鏡法や格子光シート(30)、(31)顕微鏡法は、光源を分離して光学経路を検出することで、低い光毒性で高解像度の軸イメージングを可能にする(32)。これらの技術はそれぞれ、特殊なシステムと特定のサンプルマウンティングを必要とする。しかしながら、スライドガラス、ペトリ皿、その他サンプルを自然な構造で維持するための一般的なホルダーのイメージングができない。
定量位相イメージング
QPI(33)は蛍光顕微鏡法の限界を克服する。新たな手法の急速な広がりには、回析位相(34)、デジタルホログラフィック顕微鏡法(36)、四分波横方向シェアリング干渉計(37)、タイコグラフィ(38)、強度輸送方程式ベースの技術(39)、光回析トモグラフィ(40)、配向独立DIC(41)がある。これらの手法は、光がサンプルを通過するときの波面(位相シフト)における定量的な変化によってコントラストをもたらし、生成された画像でピクセル値として記録する。ピクセル強度は光路長(OPL)の変化、すなわちサンプルの物理的な厚さと反射率に比例する。これは、QPIがサンプルの形態(42)と乾燥質量(43)、(44)を直接計測できることを意味する。複数の角度からの照明または軸のサンプル位置にまたがる位相シフトを計測す
るためにQPIを用いること(45)~(48)、逆散乱問題を解決すること(49)、(50)で、不均質なサンプルの3D構造を明らかにできる。
(もっと読む場合は出典元へ)
出典元
https://ex-press.jp/wp-content/uploads/2018/07/bioft_quantitative_microscopy.pdf
