光子を巧みに用いてナノスコープを向上させる
SPIEフォトニクス・ウェスト2018の期間中、3つある生体医学光学シンポジウム(BiOS)の総会のひとつにおいて、独マックス・プランク研究所(Max Planck Institute)のシュテファン・ヘル氏(Stefan Hell)は、遠視野の光学超分解能顕微鏡法(別称、蛍光ナノスコープ法)の新たな可能性となるコンセプトについて議論した。ヘル氏は言うまでもなく、2014年ノーベル化学賞の受賞者の一人である。新たなコンセプトである MINFIELD(1)、MINFLUX(2)、DyMIN(3)は、超分解能技術が分子分解能に到達するまでの障壁を克服するよう設計されたものだ。
ヘル氏の功績で知られる誘導放出抑制(STED)蛍光顕微鏡法は、分子放射をサブ回折サイズの領域に限定するドーナツ状の光ビームを用いて分子の蛍光を連続的にオフ(またはオン)にすることで、隣接する分子を識別できる。この手法の発見は興奮すべきものだったが、標本の光褪色を早めてしまうために制約があった。
STEDでは、光活性のあるプローブを連続的にスイッチングさせる他の超分解能法と同様、光強度がしきい値に届くか超えるときに分子は蛍光を発し(または発せず)、光強度が低いところでは反対の状態になる。蛍光から非蛍光状態に分子がスイッチするとき(またはその逆)には、しきい値を超える強度パターンの最大値を必要とする。その最大値は分解能と相関し、サブ回折スケールでは必要とする光強度が大きくなる。最高分解能に到達することは、高い光強度を意味する。イメージ作成では、分子が蛍光能を失うまで、最大強度で標本中の各分子を露光させる。低い光強度で分子が識別できるほど離れているところでは、高い光強度は必要ない。
そこで、新たなコンセプトが生まれつつある。
より狭く走査する
ドーナツの頂点部分にあたる高い光強度は蛍光スイッチングに必要はないという事実を利用するのがMINFIELDだ。その名の通り、MINFIELDは、サブ回折サイズ領域の走査を制限することで、蛍光能の損失を軽減させる(図)。スイッチングに必要な低強度のみに分子を露光させることで、MINFIELDは強度の高い有害な状態への遷移を大きく避ける。
ヘル氏らのチームは、光褪色を100倍軽減したことを示した。そして、従来の走査では十分なシグナルを得ることができなかった条件で、細部の分解能を25nm以下にできた。シグナルが強いほど記録時間も速くなるため、MINFIELDSTEDが生命科学アプリケーションの新ラインになりえると予測されている。
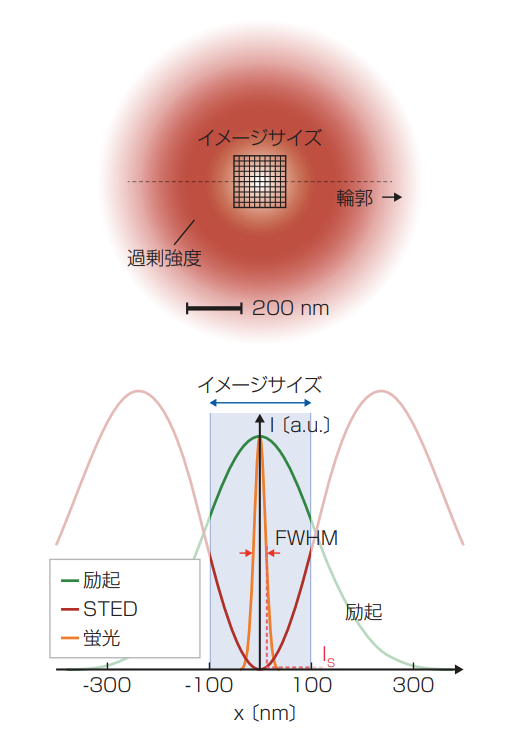
ドーナツ状の STEDの焦点ビームは、中心で焦点領域から強い光を排除させることで、エリア内のみの分子が蛍光を発する。しかし、最大光度が強いために標本は光褪色を起こし、STEDビームの波長の半分以上に光が分散する。MINFIELDは、回折限界以下のエリア(ドーナツの中心あたり)に視野像を制限する。ここでは、ビーム強度はより抑えられている。そのため、より高い分解能で蛍光シグナルを取得でき、光褪色も大きく抑えられる。(提供:マックス・プランク研究所)
(もっと読む場合は出典元へ)
出典元
https://ex-press.jp/wp-content/uploads/2018/05/wn_bio1.pdf
