メインストリームに入る光音響顕微鏡法
光音響顕微鏡法(PAM)の商業利用が可能となっている。多様なディープイメージング技術の発展が進んでおり、さらなる期待がもたれている。
近赤外(近IR)の光学顕微鏡法とイメージングはパワフルなツールであり、疾患組織の非侵襲的なスクリーニングの臨床的診断が可能である。これは体の表面だけでなく、表面下、さらに深くに位置する臓器にまで到達できる(1)。
分光技術によって、組織吸光と散乱特性の定量的検査が可能である。そして含水量や酸素飽和度やヘモグロビン濃度などのマーカーを用いて、通常組織と腫瘍組織をin vivo(生体内)で区別できる。
近IRは組織内の数cmまで到達できるが、その深度に光子が到達するころには膨大な散乱現象を受けるだろう。散乱された光子パスは、効率のよい光学的な焦点合わせを阻害する。だが幸いにも、組織内の光子は超音波を減少させ、それにより散乱が大幅に少なくなる。
誘導された圧力波を検出することでイメージを形成するハイブリッド技術により、光音響トモグラフィ(PAT)は組織内の音響散乱の低さを利用して光散乱の限界を打ち破った(2)。PATは散乱光トモグラフィ(DOT)よりパフォーマンスが優れており、細胞小器官から臓器まで幅広いサイズの生物構造をマルチスケール、高解像度でイメージングできる(3)。
PATの最先端の実装で大きな2種類は、光音響コンピュータトモグラフィ(PACT)と焦点走査型光音響顕微鏡法(PAM)である。後者はさらに、より小さい光学焦点をもたらす光学分解能(OR-PAM)と、超音波焦点をもたらす音響分解能(AR-PAM)に分類される。実装に関係なく、PAMは、異なるイメージング深度に応じて開口数(NA)を変えることで、サブ波長から数波長分まで、横方向の解像度をスケールできる。
システムとレーザ
光音響顕微鏡法は今や新しい開発段階にきており、つい最近になってシステムの商業化に至った。現在、PAMは神経科学,細胞生物学、in vivo イメージングにおけるライフサイエンス研究の進展を支えている。
初期には、PAMシステムのメーカーは1社しかなかった。米アドバンストオプトウェーブ社(Advanced Optowave)のスピンオフである米マイクロフォトアコースティック社(MPA、MicroPhotoAcoustics)は、3次元PAMの発明者らによって2010年に設立された。MPA社は、OR-PAMとAR-PAMを切り替えできる商業用PAMシステムを開発している。このシステムには、米カリフォルニア工科大(California Institute of Technology)に移る前に米ワシントン大(Washington Univer-sity)で光音響学を切り開いたリーホン・ワン氏(Lihong Wang)の研究室からライセンスを受けた多くの特許が使われている。
このシステムには、異なるモードに対応する異なる励起源が搭載されている。OR-PAMに対する励起源は2つの固体レーザで、kHz調整可能なQスイッチのファイバベースである。532nmと559nmで、5kHzのパルス繰り返し率と9nsのパルス持続時間をもたらし、sO(ヘモグロビンの酸素飽和度)イメージングに機能的な光音響トモグラフィを実現するために出力する。ARPAMに対する励起源は、8の出力波長に上がるチタンサファイアレーザシステムであり、深部にある組織のイメージングができるよう、700 ~ 900nmにわたる。OR-PAMとAR-PAMを切り替えるときの問題は、異なるコリメータレンズから構成される、シングルモードファイバとマルチモードファバと置き換えることである。
OR-PAMモードでは1mmの侵入深さ、5μmの方位分解能,30μmの軸方向を実現する。一方、AR-PAMは3mmのイメージング深さ、45μmの方位分解能、30μmの軸方向を実現する。どちらのモードもラスター走査を利用して3Dイメージを作る。走査ステップサイズは、OR-PAMで0.625μm、ARPAMで6.25μmである。 そのため、同じ領域をイメージするには、ARPAMのイメージングフレームレートはOR-PAMの10倍となる(図1)。
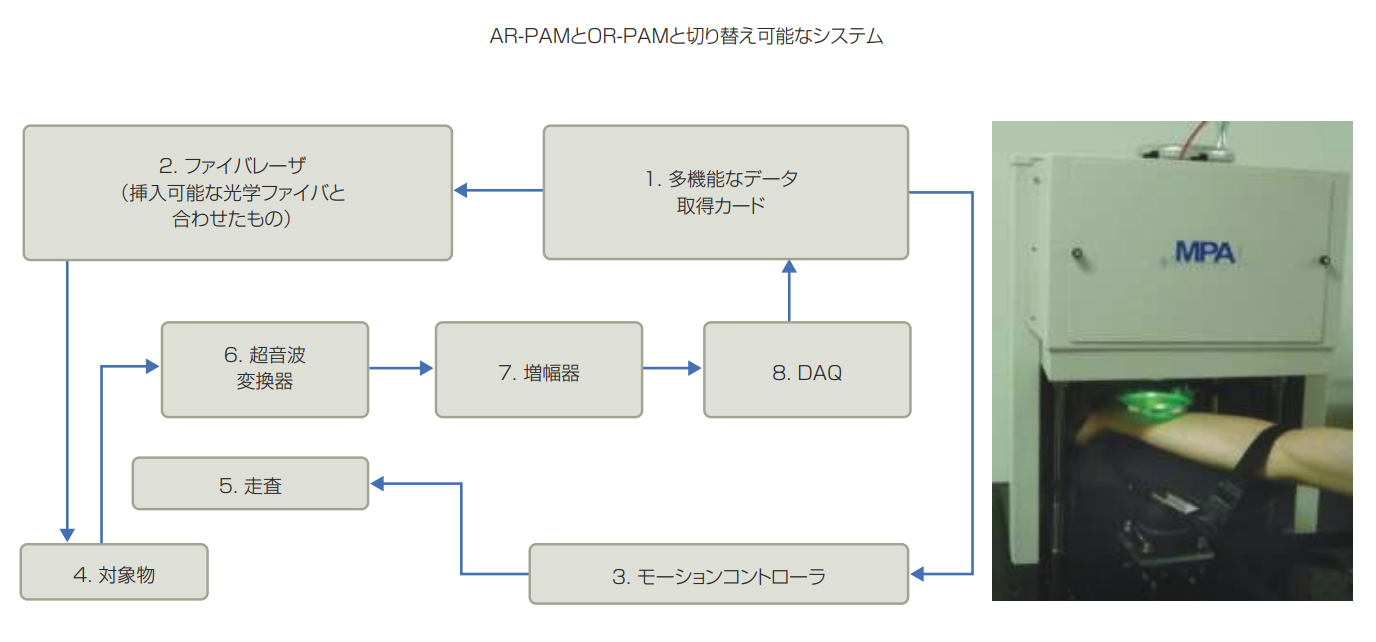
図1 MPA社の光音響顕微鏡システムでは光学分解能と音響分解能(OR-PAMとAR-PAM)モードを切り替えることができる。
(もっと読む場合は出典元へ)
出典元
https://ex-press.jp/wp-content/uploads/2017/09/bio02.pdf
