高度顕微鏡法の実用上の考慮点
研究対象の生物学を正確に描く高度イメージング法のデータを確かなものとするためには、伴となる課題の理解が必要である。
ほんの10年前では、全反射照明蛍光(TIRF)顕微鏡法や超分解能顕微鏡法は物理学者、エンジニア、学際的な科学者や研究者の領域がほとんどだった。商業的なターンキーシステムを利用できる機会が増えたことで、これらの技術に接することが大きく広がり、世界中で科学の発展を加速させている。
しかし、まれにしか使わないユーザーでも、装置の技術的基礎の知識、特に理論と実践をつなぐ考慮点に関することから得られるものはある。ここでは、いくつかの伴となる光学的考慮を取り上げる。これらは、イメージの忠実性や質、光透過率、分解能、そしてデータの信頼性を最大化するのに役立つだろう。
高い開口数の対物
定められた倍率で利用可能で最も高い開口数(NA)をもつ対物を用いることで、顕微鏡の分解能は最大化できる。ここで、空間的にお互いに非常に近い、2つの極小の蛍光粒子を考えよう。これらの粒子を別のものとして分解するためには、顕微鏡は実際のサイズで描写しなければならない。しかしながら、レンズを通した光の物理特性によって、それぞれの粒子は点広がり関数(PSF、図1)と呼ばれる3次元的な不
鮮明画像となってしまう。PSFが、粒子の実際のサイズに可能な限り近いときに、x、y、z方向の最大分解能が得られる。物理特性として、NA対物が高いほどPSFが小さくなる。
NAが達成しうる最大数は、一般的に、対物の倍率、光学収差の補正度合い、油浸レンズとともに増加する。実用的にも理論的にも、NAの限界は1.4~1.7である(対物NAは液浸媒体の光収集能と屈折率(RI)によって決まり、RIの高いオイルが最大NAを生み出す)。回折限界による顕微鏡法のXY分解能の限度は約0.25μmだったが、いくつかの超分解能顕微鏡法技術では約10倍となる約0.025μm(25nm)ま
で向上できる。
PSFの形状から推論できることとして、最大NAレンズを用いてもz方向の分解能は半分程度(約0.5μm)であり、超分解能顕微鏡法技術では約10倍以上に向上できるだろう(多くの超分解能顕微鏡法では、xy軸の分解能では大きく向上できる反面、z軸の分解能の向上はわずかだ(1))。より高いNAレンズはまた、光透過率を増加させる(すなわちシステムの感受性を最大化させる)。そのレンズは通常、最大補正プランアポクロマートレンズであり、色の忠実性、イメージの質を向上させ、画素シフト(画像レジストレーション)を減少させる。レンズのNAを最大化することで常にx-y-z分解能を最大化できるが、広い被写界深度や深い組織のイメージングのときなどは、やや小さいNAが好まれるときがある。
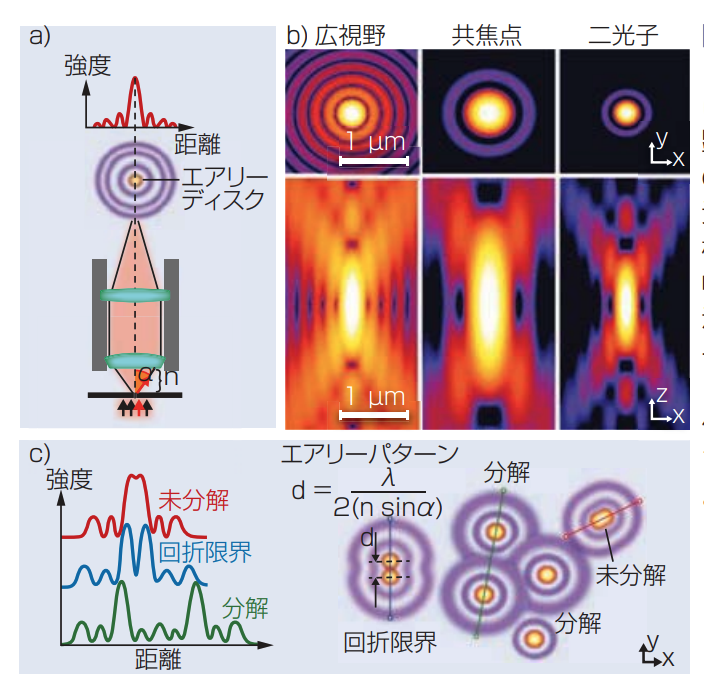
図 1 焦点面の光源点では、回折から生じる同心円状のリングパターンに囲まれたエアリーディスクとして、顕微鏡対物を描写する(a)。これらのエアリーパターン(b上段)が、3次元で投影したときにPSF(b下段)を構成する(12)、(13)。これらのPSFの幅はx、y分解能、深さはz分解能を示す。レンズのNAが高いほどエアリーパターンとPSFは小さくなり、より高い分解能となる(c)。(全ての画像は、クリエイティブコモンズのオープンアクセスライセンス供与条件による許諾に基づいて複製(14))
ダイクロイックの平坦度
一般的な落射蛍光顕微鏡では、ダイクロイックのビームスプリッタが試料に届く比較的短い波長の励起光を反射させ、試料から検出器に届く長い波長の放出蛍光を透過する(図 2)。ダイクロイックは、透過率と反射率が高いこと、レーザ波長に合ったエッジ急峻度が高いこと、後面の反射防止膜が優れていること、ガラスの自己蛍光が低いこと、レーザ損傷閾値が高いこと、透過波面エラー(TWE)が低いことが条
件である(2)。だが、最先端のイメージング技術で伴となるダイクロイックの特徴は、平坦度だ。励起経路や吸収経路でダイクロイックの平坦度が不十分だと、イメージの質、統一性、分解能、ピクセル配置、信号対雑音比(SNR)を損なう可能性があり、結果としてデータの解釈、信頼性、定量可能性に影響を与えうる。TIRFや超分解能顕微鏡は、その性質上、特にダイクロイックの収差の影響を受けやすい。
TIRFでは、ダイクロイックの屈曲がどんなものでもビームプロファイルに非点収差を及ぼすであろう。さまざまな予想しない角度で光が試料に入り、結果としてバックグラウンドの蛍光が増え、SNRが低下する(3)。大きな屈曲や表面のむらがあると、TIRFを得ることや、干渉縞の生成すら困難になりうる(4)。
似たような考慮点は、他の超分解能アプローチにも通じるだろう。構造化照明顕微鏡法(SIM)では、よりフレキシブルでユーザーフレンドリなアプローチ(5)のひとつである、システムの非点収差を修正することが、光学的分解能の劇的な向上につながるとわかっている(6)。非点収差を最小化するために、可能な限りで最も平坦なダイクロイックを用いることが大きな改善につながるはずだ。
あらゆる非点収差、そして他の収差も、実効分解能を減少させるだろう。なぜなら、そのような光学収差によって、完璧に平坦なダイクロイックが作る理想的な回析限界のPSFとは異なるスポットサイズや形状が生まれうるからだ。ピークバレー(P-V)平坦度がλ/10(0.1waves/インチ)の厚さ3mmガラスと、P-Vがλ/2(0.5waves/インチ)の厚さ1mmガラスという新しいダイクロイックは、それらの要求を満たす。そして、TIRF、SIM、PALM、STORM、STED、GSDIM、SPIM、MUM、 パターン照明、レーザを用いる共焦点顕微鏡法(図 3)、さらにLEDまたは広帯域の光源を用いる超分解能技術(図 4)のようなイメージング技術にも利点をもたらす。
誘導放出抑制(STED)顕微鏡法では、予想されるサイズ、形状、励起ビームの規則性、そして特に“ドーナツ状”の抑制ビームの規則性を変える光学収差からの影響を大きく受けやすい。われわれは非点収差を、十分に平坦でないビームスプリッタの歪曲光学収差であると見なしている(7)。さらに、STEDで要求されるドーナツ状の抑制ビームは、非点収差の影響を非常に受けやすいため、「非点収差があると焦点視野はすでにゆがんでおり、これら2つのパターンによって、おそらく超分解能の光学顕微鏡法は使い物にならないだろう」(8)。思い通りの、そして信頼できるSTEDのためには、ダイクロイックの平坦度は重要である。これら平坦度を考慮することは、パルス波と連続波(CW)両方のSTEDに当てはまる一方で、パルスのSTEDでは超高速レーザを使用するので光学最適化がさらに必要になるだろう。
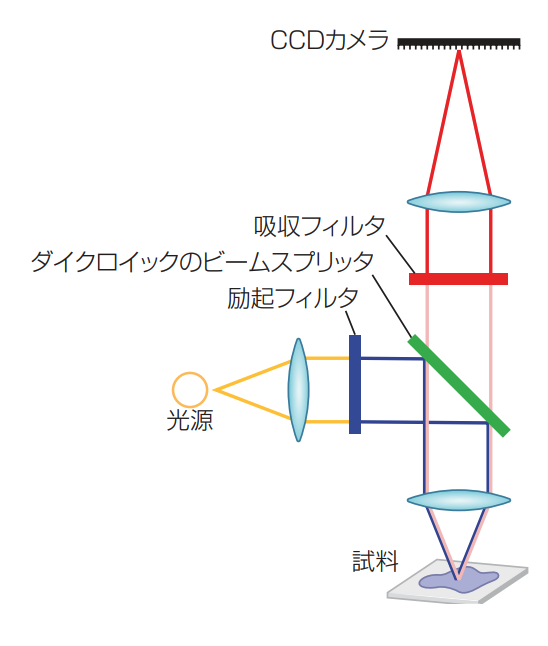
図 2 一般的な落射蛍光顕微鏡の構成では、望みの波長を分離させるために、励起光は最初にレーザを抽出するフィルタを通され、ダイクロイックで反射して試料に届く。放射された蛍光はダイクロイックに戻って透過する。検出器にシグナルが届く前に、吸収フィルタで望みの放射光をさらに分離し、不要な散乱光をブロックする。
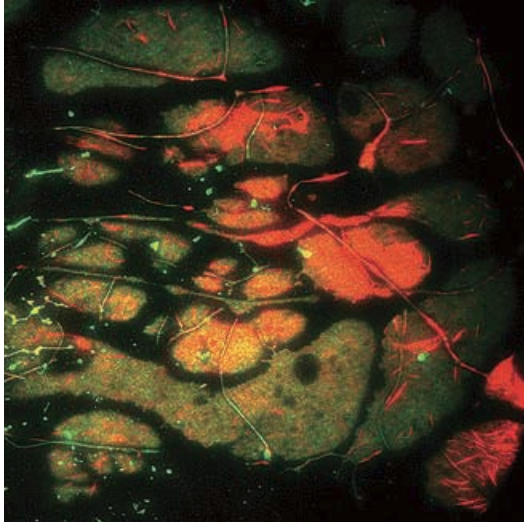
図 3 GFPカドヘリンとRFPアクチンを添加したアフリカツメガエルの胚を、セムロック 社 のLF405/488/561/635-Bで λ/2の平坦度の超分解能顕微鏡キューブを用いる二色TIRFでイメージングした。(提供: 米バージニア大(University of Virginia)のケックイメージングセンター(Keck ImagingCenter))
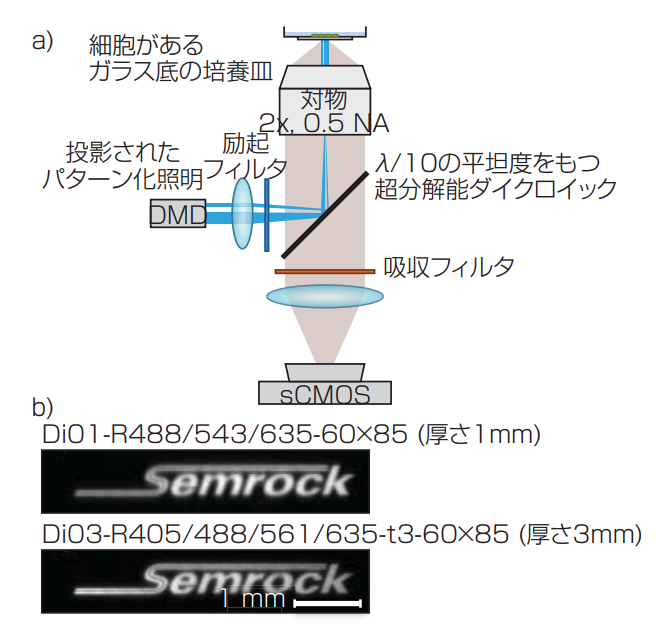
図 4 ひとつの神経細胞を光遺伝学的に刺激するためにデジタルマイクロミラーデバイス(DMD)を用いるイメージング構成では、バイナリ画像がDMD上に投影され、システムのキャリブレーションのために均一な蛍光膜が試料上で撮像される。照射パターンを伴うLEDの励起光はカスタムな60×85mmのダイクロイックで反射し、試料からの蛍光放射はダイクロイックを透過する(a)。(b)では、平坦度が不十分なダイクロイックではビーム内で収差を起こすが(上段)、セムロック社の厚さ3 mmでλ/10の平坦度をもつダイクロイックは収差を効率的に消去する(下段)(提供: Qステート・バイオサイエンス社のワーリー氏とジョン・フェランテ氏)。
(もっと読む場合は出典元へ)
出典元
https://ex-press.jp/wp-content/uploads/2017/01/LFWJ1701bio1.pdf
