MIRを用いる光学的生検に向けた動き
光源の帯域幅、明度、ポータビリティの発展によって、リアルタイムかつin vivo(生体内で)MIRイメージングする手法の開発が進んでいる。初期がんの検出などの恩恵につながると期待されている。
初期のがんを、診断できる検査は限られている。がんの後期になってから診断がなされ、それが腫瘍の転移拡散につながってしまう。そこで、早期診断できる新たな技術が重要な研究対象となっている。in vivo で医療診断できるかもしれない中赤外イメージング(MIR)が、特に注目されている。実際に欧州委員会は、MINERVA(医療診断向上に向けた中~近赤外分光法)と呼ばれるフレームワークセブン(FP7)プロジェクトを通じて、技術開発への注力を支援している。
なぜMIRなのか
1800年、サー・ウィリアム・ハーシェル氏(Sir William Herschel)は、プリズムに太陽光を透過させたものを温度計で分析したときに、可視光の虹色のうち赤の外側に「熱線」の存在に気付いた(1)。太陽光に、裸眼で見える周波数よりも短い所に「多様な色」があることを発見し、赤外(IR、ラテン語で「赤の下位」)領域と名付け、幅広い意味をもたせた。それ以降、不可視の多様なIRを、周波数によって3つの領域に分けてきた。すなわち、近赤外(NIR)、中赤外(MIR)、遠赤外(FIR)である(図1)。
MIRの興味深い特徴に、この領域における光波の振動周波数は分子結合の固有振動周波数と一致することが挙げられる。そのため、同じ周波数のMIR光を(共鳴)吸収すると、結合振動量が増加する。分子試料にMIRのさまざまな光を照射し、試料と相互作用した後の光を収集することで、あるMIR周波数の消失がわかる。この技術はMIR分光法と呼ばれており、あらゆる試料に対して使われる。消失または消失しな
い光周波数の複雑なパターンを、その材料の固有MIRスペクトルと呼ぶ(図2)。
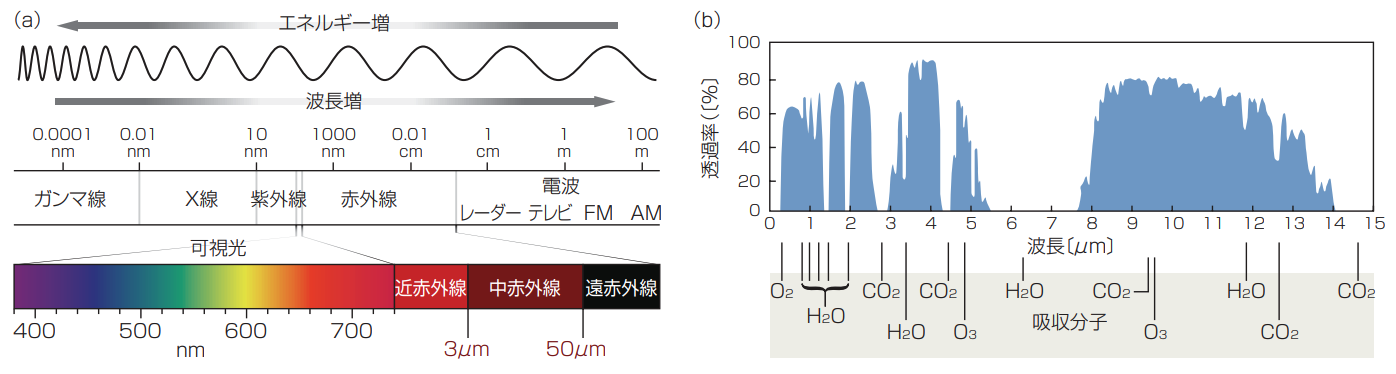
図1 電磁スペクトルの境界値については、科学コミュニティの間で見解が異なる。ISO基準では、中赤外(MIR)領域を3~50μm(波数は3333~200cm-1)と定義している(a)。この領域には、中波長(MWIR)領域と呼ばれる3~5μm、長波長(LWIR)領域と呼ばれる8~12μmという、重要な大気の窓がカバーされている。これらの大気の窓の波長制限は、およそ1マイルの海水位の透過率と一致する(4)。二酸化炭素と水分子が特定のMIR周波数においてMIRを吸光するため、MIR光の限られた周波数のみが地球の大気を透過することに注意(b)。
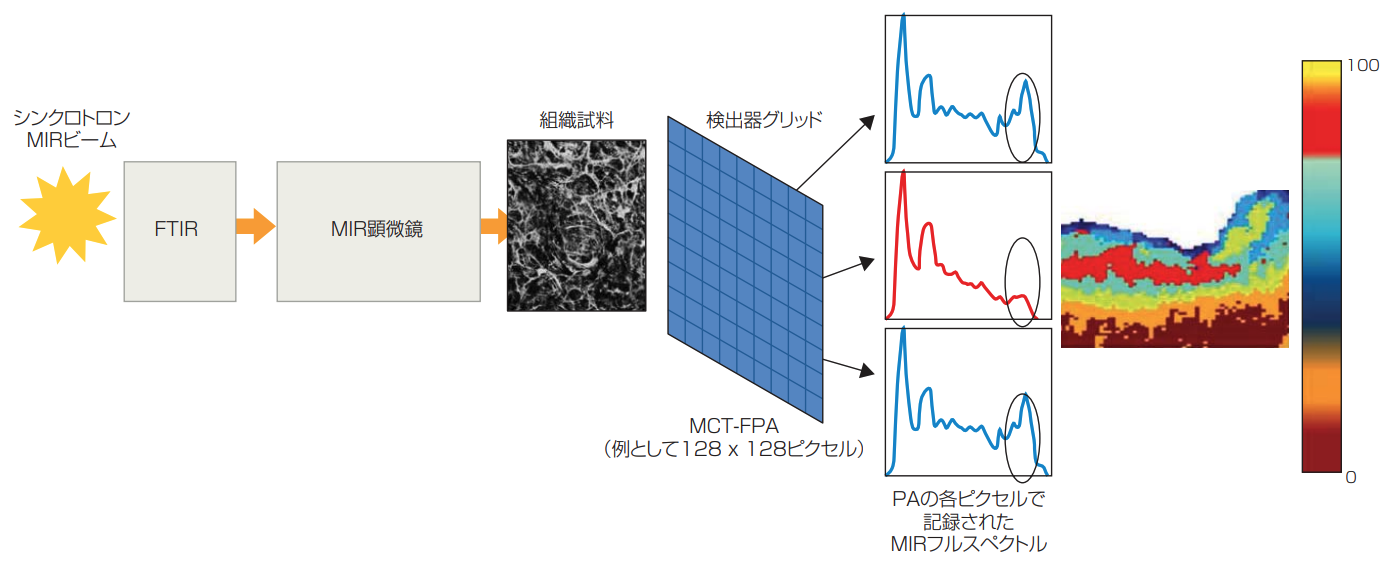
図2 切除した生物組織の従来型MIRスペクトルイメージングには、FT-MIR分光計と、MIR顕微鏡上の組織試料を透過するソース(MIR黒体、またはここで描かれているシンクロトロン発生MIRビーム)から構成されるベンチトップの装置が含まれている。MCT-FPA検出器でスペクトルイメージを捉え、各ピクセルでフルスペクトルを記録する。得られたスペクトルのセットは統計的に処理され、疑似カラーマップとして表示されるMIR組織イメージから、分子識別が可能になる。疑似カラーマップは、スペクトルパターンにおける類似性を(数学的に)確立させることで得られる。その後、スペクトルを適切に分類し、主観的割り当てから客観的なマップフリーを作成するためにカラーコードを割り当てる。
細胞や組織のMIR分子分光法
試料のMIRスペクトルによって、分子構成を検出、同定、さらには定量化できる。多くの分子気体・液体・固体、またヒトの細胞など生体組織を識別できる。それだけでなく、この技術は温室効果ガス、地中・水中・気体中の汚染物質、薬剤、毒性物質、麻薬や爆発物、食品や飲料、石油、石油製品、プラスチックなどにも応用できる。
全ての生体組織は細胞から構成されており、細胞には生体分子が含まれている(2)。DNAはその一例である。細胞や組織における生体医学MIR吸光分光計は、in vivo(生体内)ではなく、in vitro
(試験管内)またはex vivo(自然の状態から最小限の変化を伴う生体外)で実施できる。生物そのものである生体分子の一群について、そのMIR分光法を理解することは、説得力のある考えだ。
米ノースイースタン大(Northeastern University)の教授であり、生体医療分光学者のマックス・ディーム氏(Max Diem)は、in vitro またはex vivo におけるヒトの細胞や組織のMIR分光法の先駆者である。彼は論文で、従来の方法におけるMIR吸光分光法の使い方は単純化し過ぎており、正常とは異なる悪性の細胞や組織を検出できないと批判した(3)。疾患状態と正常状態の組織のMIRスペクトルの変化はわずかであり、複数のMIRスペクトルの統計分析(主成分分析やクラスタリング技術)が、これらの差異を実際に確認するのに必要だという。
ディーム氏は、細胞や組織のMIR分光法は、細胞構成、細胞成分の梱包、器官や細胞の構造、代謝プロセス、疾患の有無に関する大量の情報を得られる可能性を秘めていると強調する。彼が最初に認識したこととして最も重要なことは、細胞や組織から明らかになる分光学的情報は、21世紀の病理学を変革させるかもしれないということだ。病理学とは、臓器、組織、細胞、体液の検査を通じて疾患を研究、診断をする分野である。
現在、ex vivo の生体医療MIR分子振動吸収分光法については、切除した疾患組織と正常組織と区別できるエビデンスが蓄積されている(4)、(5)。MIR顕微鏡法と、フーリエ変換(FT)したMIR分光法を組み合わせたデスクトップ装置である顕微分光計を用いて、MIRスペクトルを収集する(図2)。MIRのさまざまな光源は、通常はシンクロトロンMIRビームか、従来型の黒体タイプのソース(GloBarなど)だ。イメージングモードでは、組織試料の側面でMIRスペクトルを収集するときは、焦点面アレイ(FPA)型のMIR水銀カドミウムテルル(MCT)検出器を用いる。ピクセルごとに捕らえた組織の平均MIRスペクトル吸収に基づいて、ピクセル化したイメージを直接収集し、疑似カラーマップとして組織試料の分子識別を描写する。MIR顕微分光法イメージングは、非破壊的、ラベルフリー、高感度であると広く認められており、特に切除組織におけるex vivoのがん研究や診断に応用されている。MINERVAプロジェクトによる、切除組織の最先端MIR MCT FPAイメージングを図3に示す(5)。
がん診断における今日のゴールドスタンダードは、色素染色した細胞や組織の顕微鏡観察(可視光を使用)を含む組織病理学である。ほとんどの大病院には「病理検査室」があり、そこでは患者から採取した切除組織を凍結させ、ミクロトームで10μm以下の厚みにスライスし、それぞれ順番に顕微鏡のスライドに乗せ、ヘマトキシリンとエオシン(H&E)色素で染色し、細胞や組織の形態(形状)を明らかにする。処理した組織を病理医が調べることで、診断や治療プランを下す。しかしながら、組織病理学は時間も人手もかかり、病理医の判断力に大きく依存している。
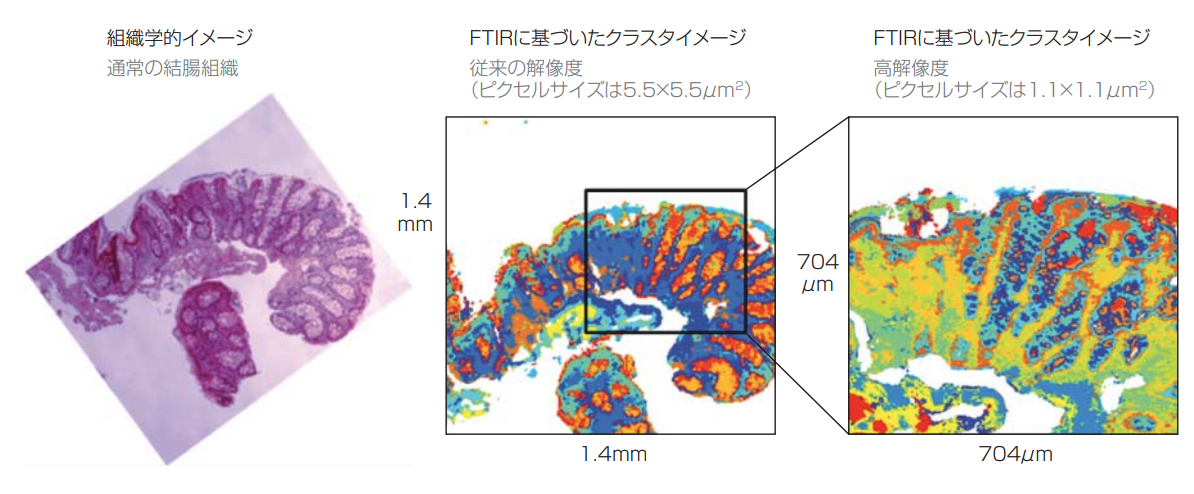
図3 切除した通常結腸組織の最先端MIRスペクトルイメージ(右)では、H&E染色した結腸組織の組織学的顕微鏡写真(左)よりも多くの情報が得られる(英エクセター大(Univer sity of Exeter)のN・ストーン氏提供(5))。
(もっと読む場合は出典元へ)
出典元
https://ex-press.jp/wp-content/uploads/2016/07/LFWJ1605_P36-39_bo01.pdf