医療診断に向けて進展する光音響イメージング
近年、レーザ、トランスデューサソフトウエア、造影剤、イメージ再構築アルゴリズムが技術的に発展したことで、光音響イメージングが進展中だ。腫瘍学、皮膚科学、治療モニタリングで新しいアプリケーションが登場しており、進展のスピードは加速している。
この10年間、光音響イメージングの進展は著しい。この進展は、レーザ、トランスデューサソフトウエア、造影剤、イメージ再構築アルゴリズムの発展によるものであり、腫瘍学、皮膚科学、治療モニタリングに需要をもたらす。この分野の成長を示す出来事として、2013年に新しいオープンアクセスジャーナル『Photoacoustics』が創刊された(1)。本記事では、特に臨床解釈のコンテクストを中心に、近年の光音響イメージング進展のスナップショットをお見せしたい。
造影剤
さまざまな光音響造影剤があるなかで利用されているものは、蛍光色素分子、金ナノ粒子、銀ナノ粒子、炭素ベースの化合物、遺伝子レポーター、“スマート” な活性プローブである。これらのうち、いくつかの光増感剤と、FDA承認のインドシアニングリーン(ICG)は、すでに臨床試験で使われており、臨床解釈に向けて進展しているだろう。
光増感剤はセラノスティクスの可能性、腫瘍の優先的取り込み、臨床的関連といった長所がある。さらに、いくつかの光増感剤における低い蛍光量子収率の限界は、光音響イメージングでは利点となる。これは、エネルギー緩和の経路における蛍光と熱発生との競合によって、蛍光色素分子が光音響信号を強く発するからである。このため、科学者はさまざまなタイプの光増感剤の実現可能性を模索している。期待できそうな光音響造影剤には、メチレンブルー、ポルフィリン、スクアライン、BODIPY、フタロシアニン、ナフタロシアニンがある。
例として、オリーヴォ氏とそのチームは、代表的な5種類の光増感剤の光音響活性を評価、比較した(2)。用いたのは、亜鉛ナフタロシアニン(ZnPc)、プロトポルフィリンIX、2,4-bis [4-(N,N-ジベンジルアミノ)-2,6-ジヒドロキシフェニル]スクアラニン、クロリンe6、メチレンブルーであり、マルチスペクトル光音響トモグラフィ(MSOT)を使用するファントム(人体パーツ模型)で評価した。その結果、5種類のなかでは、ZnPcが最も強い光音響信号を発した。次に彼らは、in vivo イメージングに取り組んだ。ZnPcを異種移植モデルのマウスに投与し、光音響イメージングを通じて生体内分布と腫瘍の取り込みを観察した。図1に示すように、ZnPcを静脈注入すると腫瘍で蓄積するようになり、腫瘍取り込みがピークに達したのは1時間後であった。この時間は光力学治療の処置で局在化するのに理想的あ
る。その後の研究では、3種類のフタロシアニンの光増感剤、すなわちフタロシアニンテトラスルホン酸(PcS4)、亜鉛(II)フタロシアニンテトラスルホン酸、アルミニウム(III)フタロシアニン塩化テトラスルホン酸の光音響活性を比較しており、PcS4がファントム、マウスいずれにおいても最も強い光音響信号を発することが明らかになった(3)。
ニツィアクリストスと彼のチームは、ダイナミックコントラストを改善するためにICGを用いている。肝臓や腎臓などの臓器や腫瘍における受動的取り込みをイメージするためである。最近では例えば、PEG化したリポソームにICGを封入し(LipoICG)、高感度で腫瘍におけるLipoICGの分布をイメージした(図2)(4)。ICG組み込みナノ粒子、ICG複合単層カーボンナノチューブなど、他のICG複合体も、光音響イメージングを目的に開発されている。
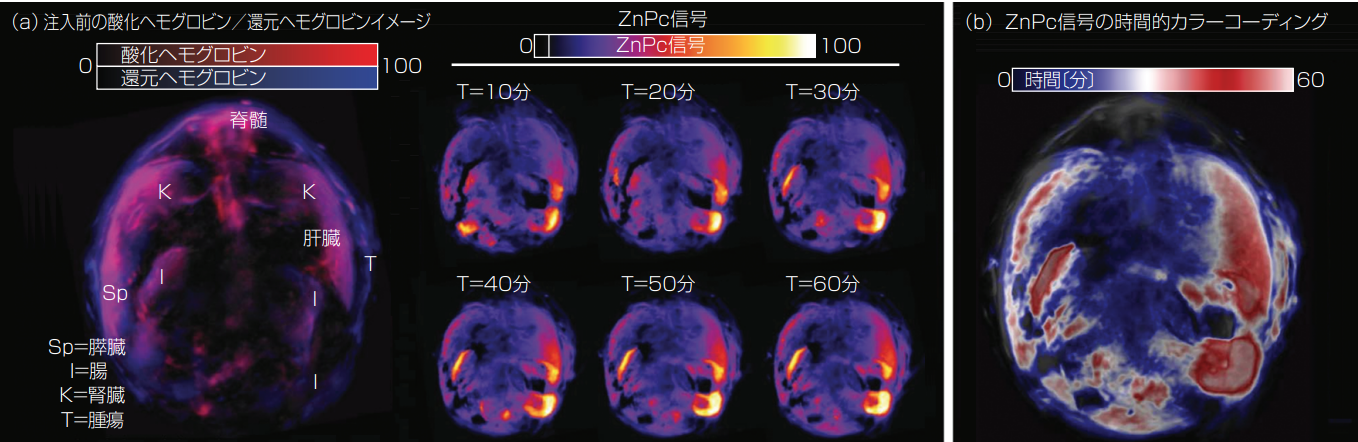
図1 (a)注入前、注入後1時間までにおけるマウスのin vivo 横断面イメージ。最大値投影法(MIP)によるイメージングで、バックグラウンド補正済み。腫瘍部位とさまざまな臓器で、時間が経つにつれてプローブが漸次的に蓄積していることがわかる。(b)注入後1時間までにおけるMSOT信号の時間分解カラーコーディングしたもの。腫瘍部位とさまざまな臓器で、注入後1時間でプローブの局在がピークに達することがわかる。(いずれもホー氏(Ho)らの許可を得て転載2)
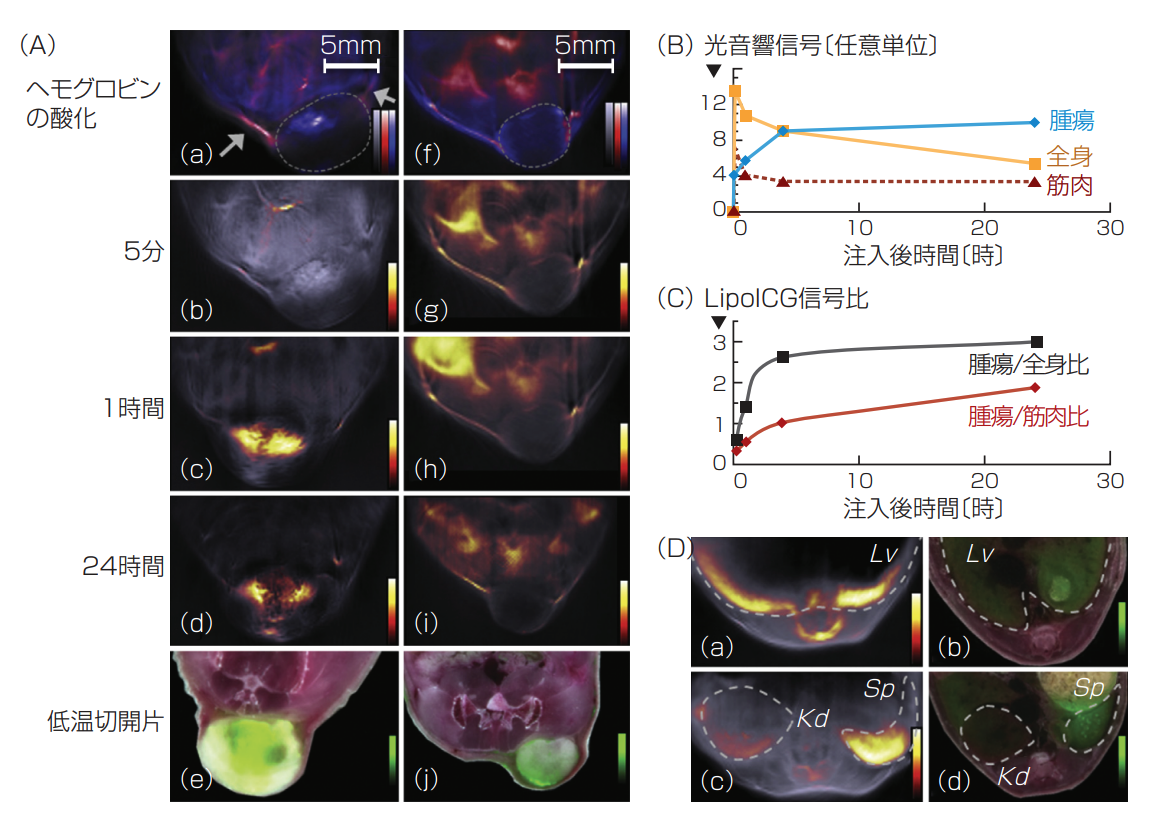
図2 4T1とHT29腫瘍モデルにおけるLipoICG75の蓄積の動態をMSOTでイメージしたもの。(A)(a)LipoICG(グレースケール)注入前の4T1腫瘍の横断MSOTイメージ。酸化ヘモグロビン(赤)と還元ヘモグロビン(青)からの信号を重ねている。矢印は、腫瘍に供給される主な血管を示す。(b-d)注入後5分、1時間、24時間におけるバックグラウンドイメージ(グレースケール)にMSOTのLipoICG75信号(ホットスケール)を重ねたもの。(e)一致する低温切開片にICG蛍光信号(グリーンスケール)を重ねたカラーイメージ。(f-j)HT29腫瘍で行われた同様の実験。(B)LipoICG75の最大信号強度。それぞれ、青の実線は腫瘍、黄色の実線は腫瘍以外の全身、赤の点線は背部筋肉における強度を示す。(C)LipoICG75の最大信号強度比。黒の実線は腫瘍と全身の比率、赤の実線は腫瘍と背部筋肉との比率と示す。(D)(a)LipoICG75信号(ホットスケール)を重ねた、肝臓(Lv)の担がん動物のMSOTイメージ。(b)一致する低温切開片にICG蛍光(グリーンスケール)を重ねたもの。(c,d)同じ動物における腎臓(Kd)と膵臓(Sp)領域。(いずれもベジーレ氏(Bézière)らの許可を得て転載4)
光源と検出器
光音響イメージングでは、組織が吸収するエネルギーをもつナノ秒パルス発生光源を使う。このパルスレーザ源を患者に使うには、米国国家規格協会(ANSI)が定める最大許容線量(MPE)である20mJ/cm2の制限を満たしたうえで、標的組織に均一表面照射しなければならない。高パルス繰り返し率は動きアーチファクトを最小化でき、特にハンドヘルドのイメージングでは有効だが、パルスあたりのエネルギーはMPEの制限を受ける。
出力を測定するときには、感度とロバスト性に優れているという理由から圧電検出器が一般的に用いられる。しかしながら、広帯域で容電性であるマイクロマシンベースのような、より複雑な検出器も開発されている(10)、(11)。
近年におけるレーザ、トランスデューサ技術、演算能力の発展により、従来の光音響システムのサイズとコストが下がり、ハンドヘルドのプローブベースのシステムに組み込めることができようになっている。これにより、ポータブル超音波システムとほぼ同じサイズにできる。例として、科学者らはビデオ速度を改良し、ハンドヘルドベースのMSOTイメージングシステムを開発することで、ヒトのボランティアにおける組織形態と血管系を解像しようとしている(12)、(13)。他には、リアルタイムで超音波・光音響イメージングという二重イメージングを実現するために、従来の超音波システムと接続できるハンドヘルドなプローブを設計している(14)。このようなリアルタイムイメージングは、心血管疾患、リンパ管疾患、炎症、腫瘍学などのアプリケーションにおいて大きな診断可能性をもたらす。
(もっと読む場合は出典元へ)
出典元
https://ex-press.jp/wp-content/uploads/2016/03/LFWJ1603_P42-45_Bio01.pdf
