散乱組織の超高速レンズなし撮像を可能にするホロスコピー
ホロスコピーとして知られるデジタルホログラフィーと光コヒーレンストモグラフィー(OCT)の組み合わせは、可動部品を使用しないので、3D画像の同時取得を極端に高いデータスループットと高い撮像速度で実行できる。
光学撮像の進歩は生物医学に大きな変革をもたらし、光学顕微鏡が発明され、バイオチップやフローサイトメトリが生まれ、非線形顕微鏡法の最新版も登場した。しかし、そこには理解すべきことがたくさんある。生物学は高分子、細胞小器官、細胞の3 者が同時に相互作用する3 次元サイエンスが基本になっている。これらのミリ秒レベルの時定数の巨大な並列で動的な生物学的相互作用は、生命の途方もない複雑さの基盤であり、その適切な研究には高速の非侵襲性撮像モダリティが必要になる。残念なことに、大きな生体組織を直列走査する現在の顕微撮像技術は動作があまりにも遅い。
共焦点イメージングと非線形顕微鏡法は、生体組織の損傷と光物理/光化学飽和効果の閾値が励起フラックスとボクセル(2次元のピクセルに対応する3次元の最小単位)当たりの最大光子発生率を制約する。共焦点の直列走査は撮像高速化のボトルネックになる。
多波長の光干渉を利用してさまざまな散乱構造の深さを決定するフーリエ領域光コヒーレンストモグラフィー(FD-OCT)は、今日の最高速撮像モダリティの1 つになっている。すべての深さからの光子の強い散乱信号を同時検出することで、その撮像速度は毎秒ギガボクセルに達する。しかし、この同時検出は共焦点イメージングを使うため、光ビームウェストの内部にしか適用できない(図1)。0.05の開口数(NA)の場合、透明媒質に埋め込まれた酸化鉄ナノ粒子のOCT画像は焦点面近傍の狭い領域の粒子として観察される。すべての体積を撮像するには異なる深さの連続走査が必要になる。分解能を向上し、捕集光子数を増加しようとしてNAを大きくすると、焦点深度がさらに狭くなる。
究極の撮像速度を得るには撮像プロセスの二重並列化が必要になる。この方法は拡張ビームを用いて組織を照射して焦点の高輝度を防ぎ、すべての戻り光子を高NA で捕集し、それらが発生する深さとは関係なしに発生源を同時に位置決めする。可変波長光源とカメラを使用して共焦点なしのOCT撮像を行うフーリエ領域全視野OCTは、すべての深さの照明と検出を同時に行うが、焦点面の外側ではぼけた画像しか得られない(1)。
しかし、フーリエ領域全視野掃引光源OCTは、特定面のイメージングばかりでなく、全体積を回折限界の分解能で画像化できるデジタルホログラフィー(DH)と組み合わせることで、すべての深さの高分解能画像を取得できる(表1)。両者を組み合わせたホロスコピーはすべての散乱光子の検出が可能であり、その発生源を高い横方向と軸方向の分解能で追跡できる。ホロスコピーを用いたときの撮像速度の増加は、レイリー散乱長の2倍(2 zR )に対する所望の被写界深度(DOF)の比から推定できる。DOFは通常の方法で鮮明な画像が得られる深さ領域を意味している。NAが0.8でDOFが100μmの場合、ホロスコピーは異なる面の200枚の画像を1つの大きな画像に置換できる。
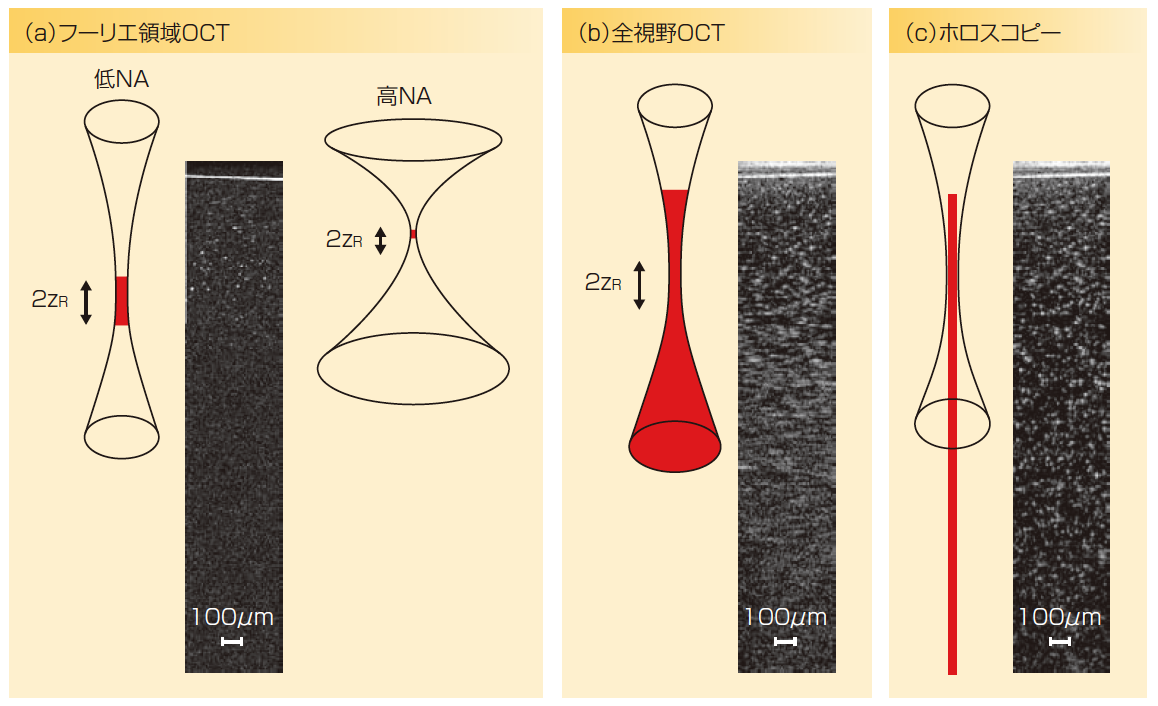
図1 散乱ナノ粒子をもつ試験物体を使用して、光コヒーレンストモグラフィー(OCT)、光コヒーレンス顕微鏡法(OCM)、掃引光源全視野OCTおよびホロスコピーの被写界深度(DOF)と横方向分解能を比較した。DOFと横方向分解能をガウスビームウエストに関係付けて(赤色)図解している。
ホロスコピーの登場
ホロスコピーの発想は60年以上も昔に生まれた。デニス・ガボールは1949年に、分離された参照波による干渉を用いて散乱光場の全体情報を記録し回復するホログラフィーを提案した(2)。エミール・ウルフは1060年代の終わりに、それほど強くない散乱体積からの光には内部散乱構造の全情報が含まれることを明らかにした(3)、(4)。1970年代の終わりになると、フェルチャーらはホロスコピーの発想の実験による実証を報告した(5)。しかし、デジタル記録媒質と計算能力が不足していたので、この研究は実用的な価値が得られなかった。
(もっと読む場合は出典元へ)
出典元
https://ex-press.jp/wp-content/uploads/2012/06/201206_0026feature02.pdf
