生命工学と医学の専門家に新しい見方を提供するスペクトルイメージング
革新的なスペクトルセンサが医療と医薬品の開発・製造において利用するラマン、多点、ハイパースペクトルセンサを精緻化する。
分光装置は多くの場合、過度に複雑で高価である。それゆえ、スペクトルセンサがヘルスケアおよびバイオメディカルの市場においてより普及し、より使いやすくなるには、しばらく時間がかかる。しかし、これらの分野では、スペクトル検出がそのタイプを問わず診断の改善と生活の質の向上に対して高い利便性をもたらしている。
医学的応用では、一般に、2タイプの分光法、ラマンイメージングとハイパースペクトルイメージングが注目されている。これらの方法は非侵襲的な医療スクリーニング、ゲノミクス、医薬品製造などに役立つ。
いずれの場合にも、目的は肉眼では見えないものを、試料内のスペクトルシグネチャを調べることを通して「見る」ことである。単一点実験機器に比してスペクトルイメージングが優れている点は、より大きな物体(アッセイアレイ、組織サンプル、人の手など)のスペクトルと空間マッピングが高解像度で得られることである。数百の個々のシグナチャを表示するスペクトルライブラリと結びつけられて、病原体またはバイオマーカーが実時間で測定され、マッピングされ、報告される。データ処理と生体情報解析の進歩によって、これらのスペクトルシステムは骨の折れる仕事をより迅速かつ低廉に実行し、広範囲の医療機関で利用されている。
生物医学領域用のラマン分光法
ラマン分光法は紫外(UV)、可視(VIS)、近赤外(NIR)領域のレーザを利用する技術である。試料をレーザで励起して、正確な試料識別が可能な信頼できるストークス「指紋」を誘起する。一般的な励起波長は248、355、532、685、632.8、785、830、および1064nmである。機器の選択は化学結合の振動状態と分子の対称性に依存する。
レーザ光が試料によって吸収されると、そのエネルギーは分子結合を振動させ、その振動は緩和を起し、より長い波長の光子を放出するまで続く。試料から収集された光は、励起波長を取り除くためにまずフィルタされ、次いで検出器へと送られる。測定されたスペクトル応答は、分子の識別を可能にする特異スペクトルの指紋である。励起レーザと1Dファイバアレイ下で試料を走査することによって、完全なラマンスペクトルが取得され、スペクトル中の各波長での試料画像が分離して形成される。これは、1 つのスペクトル取得に要する時間は数ミリ秒であり、完全な3D 画像もほんの2、3 分で形成されるため、従来のシングルポイントラマン方式を上回る利点である。
高分解能のラマンスペクトルはバイオメディカル分野での診断や研究に適した技術となっている。しかし、ラマン信号は概ね非常に弱い。イメージング検出器の成熟はごく最近になってのことであり、ようやく高量子効率(QE)カメラが幅広い利用に妥当なコストで市場に出回るようになった。検出器技術の進歩によって、ヒ化インジウムガリウムとシリコンチップはより小さな画素でより広い帯域に及び、より弱い信号を検出できるようになった。
レーザダイオードとダイオードポンプ固体レーザにも同様の進歩があり、より低価格で、より明るい照明が可能になった。ファイバが伝統的にラマン信号の送出と収集の手段であったが、顕微鏡ベースラマンシステムが多くの生体試料で受け入れられるようになった。
ラマンシステムを利用した興味深い事例研究が米オレンジ・カウンティー小児病院で行われた。そこではヘッドウォール・フォトニクス社製のラマン・エクスプローラが腫瘍の識別に使われている(図1)。
この研究チームの解析によれば、いずれのラマンシステムでも主要な測定基準はラマンスペクトルの光スループット効率であった。この機器は、スペクトル帯域全般にわたる高いSNRと解像度を維持しながら、試験速度を向上させた。研究チームは、スループット効率が他の機器に比べて最高221%大きいと評価した。
収差補正光学系はキーストーンとスマイル画像劣化も取り除いた。これらの光学収差の最小化は高価なポスト処理を不要にし、歪みなしの結果を高速で表示した。
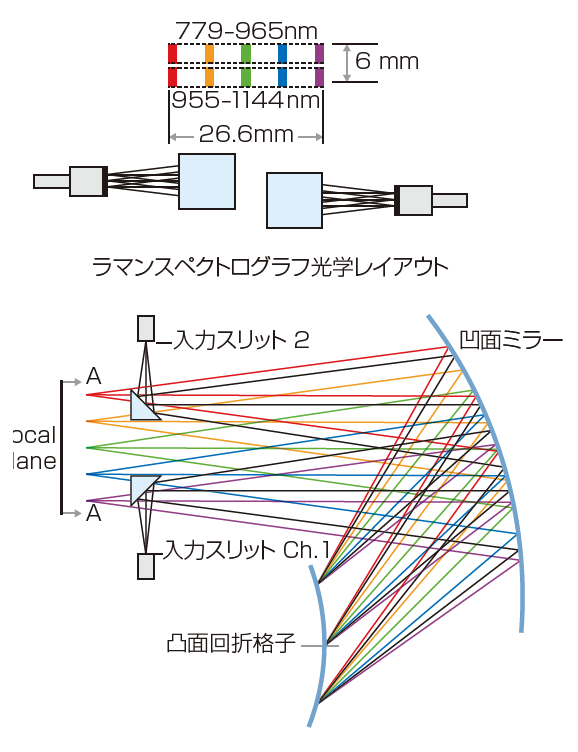
図1 ラマンエクスプローラセンサ設計は収差補正回折格子を使った多入力の再帰反射同心円設計である。ここで、レーザ励起は785nmで行われた。
多点分光計
この研究室では、ラマンイメージングシステムを並列測定アレイで使用している。これらのシステムは、レーザ励起に特殊な光ファイバを使うことによって、40 本ものファイバからのラマンスペクトルを走査なしで同時に取得する。ファイバアレイ装置はチャンネル間のクロストークがつきものだが、収差補正光学系を使った撮像装置はこのクロストークを最小化する。そのため、研究者たちは自由溶液環境内の単一分子の正確な検出と識別を高分解能で達成することができる。
マルチフルイディックチャンネルの長さ全体にわたる実時間での分子追跡にファイバアレイを使えば、反応前、反応中、反応後のラボ・オン・チップ解析を1台の機器で継続して実施できる。
ラマンイメージングは時間分解研究解析の機会をバイオマーカー、DNA断片、多形スクリーニング、ゲノミクスなどへと広げた。これまで、このデータ量は研究室設備でさえ大きすぎて扱いにくかった。しかし、データ処理パワーはムーアの法則に従って発展を続けているので、同時時間分解測定が無理なく利用できるようになった。
結果として、大学の実験室や医学研究施設でも、この技術に投資し、医療用途向けにこれを改良することが可能になった。例えば、マサチューセッツ工科大学(MIT)で開発された装置は血糖値を非侵襲で監視する方法を提供する。NIR 光を使って患者の腕または指を走査した後、この装置は収集されたラマンスペクトルからグルコースレベルを直接読み出し、採血の必要性を排除した。この装置はサイズが標準的なノート型パソコン程度であるため、医師のオフィスまたは家庭キットとして使用することができる。
(もっと読む場合は出典元へ)
出典元
https://ex-press.jp/wp-content/uploads/2012/12/201212_0032feature04.pdf
