チップスケールの分子センサを創製するQCLファセット上プラズモンアンテナ
中赤外近接場走査光学顕微鏡装置を使って、パタン化饂子カスケードレーザ(QCL)の近接場画像を観察し、そのトポグラフィを試験した。
蛋白質や薬剤などの多くの生体分子は電磁スペクトルの中赤外線(MIR: 2~30μm)領域に固有振動をもっため、MIR光源を使用する分子バイオセンサが非常に望ましい。あいにく、レーザ発振波長がプローブされる分子のサイズに比してかなり長いため、MIR光源と生体分子間の光—物質相互作用は弱い。
この難題を解決するために、米ノースウェスタン大学の電気工学·計算機科学部教授のフーマン・モーセニ氏をリーダとするバイオインスパイアードセンサ・オプトエレクトロニクス研究所(BISOL: www.bisol.northwestern.edu)のチームは、光をナノメートルスケール以下に集束させ、近接場強度を大幅に増強する光ナノアンテナをQCLと一体化させた(1)。平面パッシベーション構造。
ハイブリッドアプローチ
ほとんどのプラズモンナノアンテナの設計では金属材料だけを使用している。しかし、ノースウェスタン大学チームが提案したハイブリッド金属誘電体金属(MDM)プラズモンナノアンテナは、そのモードを約500nmのナノメートルスポットサイズ内に閉じ込めることによって、全金属設計に比べて約4倍強い近接場強度を達成した。
このMDM ナノアンテナ設計を最適化するために、有限差分時間領域(FDTD)モデリングソフトウエアを使って、近接場ピーク強度の増強とQCLフロントファセットに結合させたナノロッドアンテナの長さとの関係をモデル化した。この構造の作製にあたって、最初に、ヒ化インジウムアルミニウム/ヒ化インジウムガリウム系QCLの表面を金、ニ酸化ケイ素、金のMDMサンドイッチ構造(各厚みは75、30、75nm)でコーティングした。次いで、集束イオンミリングを使ってQCLフロントファセット上にナノロッド構造を作製した。ナノロッドのサイズは約2.0μm x 200nmである。
このパタン化QCLの近接場画像を観察し、そのトポグラフィを試験するために、MIR近接場走査光学顕微鏡装置を使用した(図1)。実験では、鋭角に白金被覆された原子間力顕微鏡(AFM)の先端でQCL(1%のデューティサイクルをもち1OOkHzでパルス幅1OOnsのパルスモードで動作)の表面を走査させ、アンテナ構造に由来する電磁場を散乱させた。散乱された倍号はレーザ共振器を通って逆方向に進み、コリメートされ、その後対物レンズによってテルル化カドミウム水銀(MCT)検出器上に集束された。ロックイン技術によってAFM チップによる雑音が除去され、その結果得られた信号が、作製されたナノアンテナの近接場強度パタンの画像を形成した。
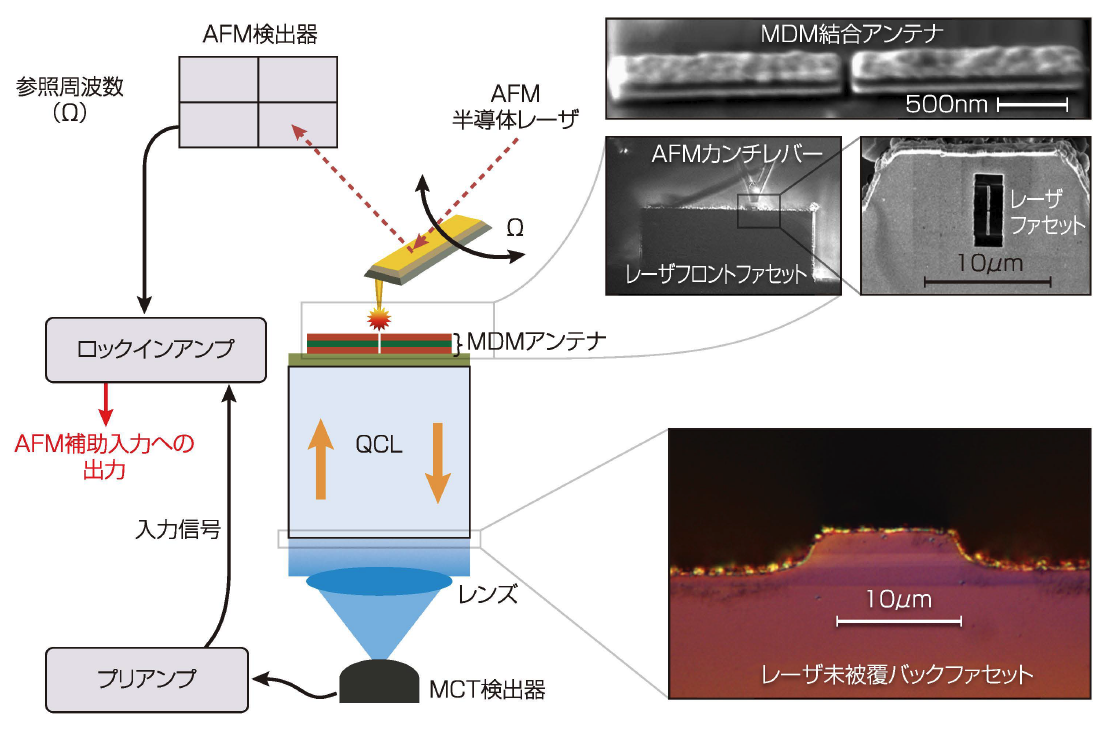
図1 近接場走査光学顕微鏡を使って、QCLのフロントフアセットに結合されたプラズモンナノアンテナによって可能になった電磁場増強が測定された。この局所電場埋強はこのデバイスを将来のMIRバイオセンサ用途に向けて確実なものにする。(資料提供:ノースウェスタン大学)
(もっと読む場合は出典元へ)
出典元
https://ex-press.jp/wp-content/uploads/2010/12/0d36a411716acb129f809cf66c5cfbab.pdf
