黄色CW OPSLの利用によって進歩するSTED技術を用いた超解像顕微鏡
低ノイズの577nm連続波(CW)光励起半導体レーザ(OPSL)によって、研究者たちは青色/緑色蛍光体を使用して、かつてない解像度で細胞の構造と膜動力学をイメージングすることができるようになった。
研究者たちは、生物学上の主要な疑問に答えるには回折限界を越える光学顕微鏡を押し進める必要があると考え、誘導放出抑制(STED)がこの目的を達成しうる蛍光イメージング法であることを証明した(1)。最初は超高速パルスレーザを使って実証が行われていたが、CWレーザの利用によってSTEDはかなり簡素化され、実装コストも低減された(2)。ゲート制御された検出スキームとの組み合わせは、試料に照射するレーザパワーを大幅に低減し、生細胞イメージングにおける細胞の光損傷を最小化する役割を果たした(3)。
本論文では、生物学的に重要とされるスペクトル領域で最も低い出力ノイズを提供するCW、577nm OPSLのSTED効果に対する最初の適応結果について報告する。例として、細胞膜内のナノスケールの分子運動や相互作用の観察を可能にするSTEDと蛍光相関分光法(FCS)の組み合わせに対するこのシステムの利用についても考察した(4)。
STEDナノ顕微鏡法
現在、生物学者たちは分子の挙動を巨視的挙動に結び付ける努力をしている。例えば、どのように細胞が互いに信号を送っているか、その際に、どのようにして細胞/生命体レベルの信号が逆に単一遺伝子を調節するDNA / RNAレベルの制御に中継されるのかを決定するといったことである。これは可能な限り高い空間分解能と実時間で動的なサブ細胞イベントを追跡するに十分な時間分解能で化学、活動度、構造を結び付けることを意味している。
蛍光顕微鏡法は、色素、標識、または蛍光タグを付けた遺伝子生成物が特定の分子またはイオン(例えばCa2+)の位置と運動をマッピングするなどして、この重要な研究の多くを支えている。しかし、光学顕微鏡法の空間分解能は回折によって光源波長の約1/2の詳細レベルに制限されている。
多光子励起、構造化照明、4π顕微鏡法などの技術は、この回折限界によって生じる空間分解能の壁をその絶対限界にまで押しやったが、この壁を真に壊すことも、無制限な分解能を提供することもできていない。STED顕微鏡法は、原理的に無制限の空間分解能で3D画像を生成することができ、広範囲の適用性と速度を持つ最初のアプローチとして登場した(1)。結果として、STEDはナノスケールの生物学的イベントをリアルタイムで調べる実験に実際に利用されるであろう。さらに重要なことは、今や、STEDはライブセルにおけるこれらの研究を可能にする潜在能力を示している。
STED技術
STED ナノスコープは2 本のレーザビームを使う。1つ目は励起レーザであり、これは、通常、共焦点顕微鏡のように蛍光標識された試料内の回折限界に近いスポットに集光される。このレーザの励起波長はターゲットの蛍光体の吸収ピークと一致するように選択される。
共焦点顕微鏡では、アパーチャを使用して、光検出器が集光ビームと一致するx-y-z点で励起された蛍光だけを「見る」ようにしている。その際3D画像はこのスポットを連続するz軸方向の深度でx-yラスタ走査することで構築されている。
STEDでは、共焦点アパーチャではなく、2つ目(STED)のレーザビームと励起レーザを重ねることによって、分子が検出されるx-y-z体積を定義する。特に位相マスクが1つないし、暗(0強度)中心をもつドーナツ形のビームで焦点強度分布を生成するために使われている(図1)。STEDレーザ波長は励起レーザの波長よりも長い波長にその中心をもっており、誘導放出による蛍光体の励起状態を抑制する。
一定の閾値よりも十分に高いSTEDレーザパワーを適用すると、STEDビーム光路内で励起された蛍光はすべてSTED波長を放射してしまうため、(自然)蛍光として利用することはできない。結果として、1つ目のレーザで励起された蛍光はSTEDドーナツの中央の暗いホールにだけ存在することができる。蛍光抑制が回折限界より小さなサンプリング領域で定義するために使用される理由は、レーザ強度の依存性から導き出されている。すなわち、STEDレーザ強度を誘導放出された蛍光の抑制閾値に対して高くすると、蛍光が許容され続ける領域(すなわち蛍光検出でサンプリングされる領域)が効果的に縮小されるためである。
セットアップと位相マスクの依存によってSTEDはx-y面または3つの全空間(x-y-z)軸におけるサンプリング量を減少させることができる(1)。 そのとき、2Dまたは3D画像は、共焦点顕微鏡と同様に、試料を横切って試料体積を走査することによって構成される。すでに言及したように、蛍光量の減少、すなわち画像から得た空間分解能は原理的に無限大となっている。これまでの実験で、STED画像では、細胞内で20nm以下、固体材料で5nm以下の解像度、すなわち、回折限界共焦点の場合に比べて1600倍小さい観察エリアで取得されている。
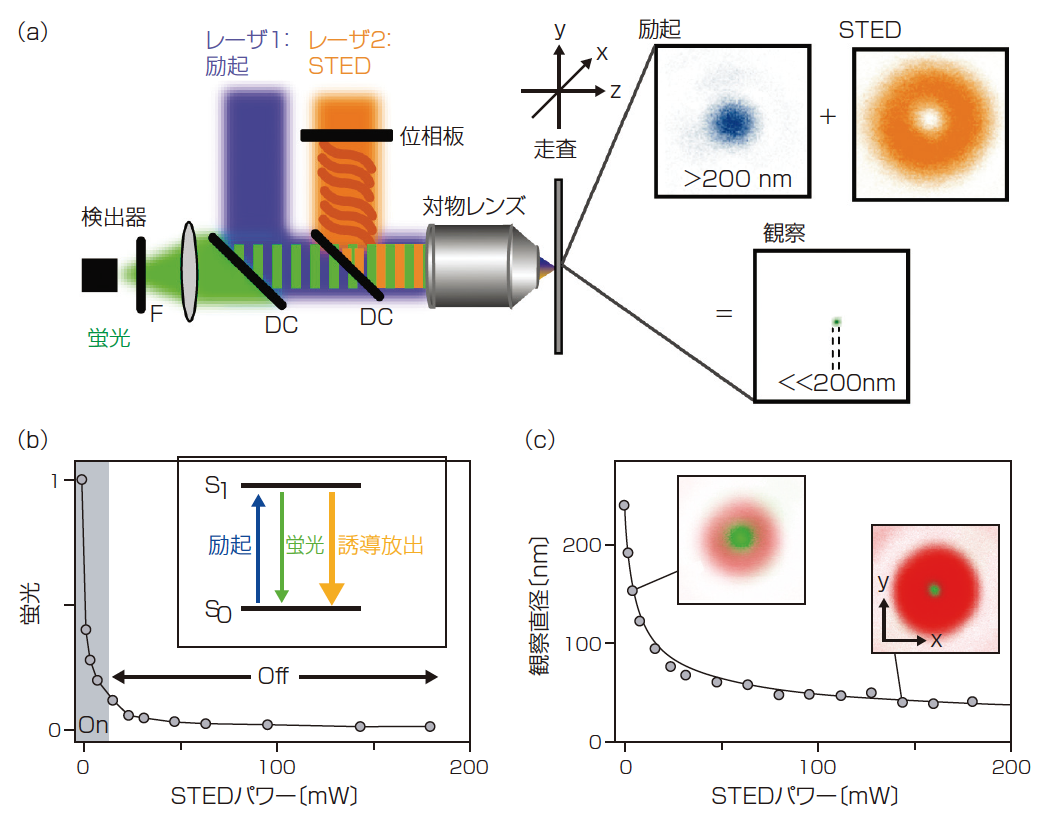
図1 STEDの原理。(a)位相板、対物レンズダイクロイックミラー(DC)、蛍光フィルタ(F)、検出器、走査装置、励起とSTED レーザなどからなるSTEDナノスコープのセットアップの概略図と、それらの焦点強度分布(右)と代表的なサブ回折サイズの観察エリアを示した。(b)STEDナノスコピーは、励起S1 状態からS0基底状態への脱励起によって誘導放出蛍光放射を抑制することに基づく。蛍光体をスイッチオフする確率はSTEDパワーの増加とともに増加した。(c)このパワー依存性はサブ回折サイズの観察体積を提供する。いぜんとして蛍光放射が可能な体積(緑、挿入図)はSTEDレーザパワーの増加につれて減少する。
CW-STED
当初はSTED はパルスレーザを用いていた。STEDパルスが励起パルスにすぐに続くように設定していた。この条件は、高いレーザピーク強度とタイミングの期間において最適なSTED 作用を保証するため、最も高い効率で蛍光の抑制を実現する。
(もっと読む場合は出典元へ)
出典元
https://ex-press.jp/wp-content/uploads/2012/03/201203_0038feature02.pdf
